26 Août Un super bouchon contre le coronavirus
Une approche thérapeutique développée par les scientifiques de l’Institut Weizmann des Sciences donne un nouvel espoir dans la bataille contre COVID-19.
Même si les vaccins peuvent orienter le monde vers une vie post-pandémique normale, un SRAS-CoV-2 en mutation constante nécessite le développement de médicaments efficaces. Dans une nouvelle étude publiée dans Nature Microbiology, les chercheurs de l’Institut Weizmann, en collaboration avec des chercheurs de l’Institut Pasteur à Paris et du National Institute of Health (NIH), aux États-Unis, proposent une nouvelle approche thérapeutique pour lutter contre ce virus notoire. Plutôt que de cibler la protéine virale responsable de l’entrée du virus dans la cellule, l’équipe de chercheurs s’est penchée sur la protéine présente sur la membrane de nos cellules qui permet cette entrée. À l’aide d’une méthode d’évolution artificielle avancée qu’ils ont développée, les chercheurs ont généré un « super bouchon » moléculaire qui bloque physiquement ce « port d’entrée », empêchant ainsi le virus de se fixer à la cellule, et d’y entrer.
La plupart des thérapies potentielles (et les vaccins actuels) pour le SRAS-CoV-2 ciblent la protéine dite « protéine Spike » trouvée sur l’enveloppe externe du virus. Cette protéine virale est cependant sujette à des mutations qui érodent l’efficacité de ces traitements. « Étant donné que le virus évolue constamment, nous nous sommes plutôt concentrés sur le récepteur humain, qui ne mute pas, appelé ACE2 et qui agit comme site d’entrée du virus », explique le Professeur Gideon Schreiber du Département des Sciences Biomoléculaires de l’Institut Weizmann, qui a supervisé la nouvelle étude. Cette approche n’est pas sensible aux mutations des nouveaux variants viraux, ce qui est l’un des principaux défis dans la lutte contre la pandémie.
Cependant l’ACE2, fixée à la membrane des cellules épithéliales pulmonaires et d’autres tissus, est une enzyme importante pour réguler la pression artérielle. Par conséquent, aussi tentant que cela puisse être de simplement bloquer ce récepteur pour empêcher l’entrée du SRAS-CoV-2, une telle stratégie ne doit pas interférer avec la fonction de l’ACE2. Schreiber, dont le laboratoire est spécialisé dans l’étude des interactions entre protéines, a entrepris de développer une petite molécule de protéine qui pourrait se lier à l’ACE2 beaucoup plus solidement que le SARS-CoV-2, sans pour autant affecter son activité enzymatique.
Les chercheurs, dirigés par le Dr Jiří Zahradník, chercheur postdoctoral dans le groupe du Professeur Schreiber, ont commencé par identifier, au sein de la protéine Spike, le « domaine de liaison » du SRAS-CoV-2 : c’est à dire la petite partie de la protéine Spike qui entre en contact direct avec l’ACE2. Utilisant le propre domaine de liaison du virus comme arme contre lui-même, le Dr Zahradník a effectué plusieurs séries d’ « évolution dans un tube à essai », une technique développée dans le laboratoire du Professeur Schreiber sur une souche de levure de boulanger génétiquement modifiée exprimant le domaine de liaison. Comme la levure peut être facilement manipulée, le Dr Zahradník a pu analyser rapidement des millions de mutations différentes qui se sont accumulées au cours de cette évolution artificielle, un processus qui imite l’évolution naturelle à un rythme beaucoup plus rapide. En fin de compte, l’objectif était de trouver une petite molécule qui serait significativement « plus collante » que la version virale originale.
Au cours de ce processus d’analyse, l’équipe du Professeur Schreiber a fourni des preuves solides en faveur de l’hypothèse selon laquelle le SRAS-CoV-2 devient plus contagieux lorsque des mutations améliorent son ajustement à l’ACE2. Les chercheurs ont découvert que déjà après le premier tour de sélection, les variants fabriqués en laboratoire avec des capacités de liaison plus fortes à l’ACE2 imitaient les mutations présentes dans les domaines de liaison des souches de SARS-CoV-2 les plus contagieuses qui s’étaient produites au cours de l’évolution naturelle, comme le variant britannique (Alpha), le variant sud-africain (Beta) et le variant brésilien (Gamma). Étonnamment, le variant indien (Delta) désormais répandu repose sur une astuce différente pour être plus contagieux – en échappant partiellement à la détection par le système immunitaire.
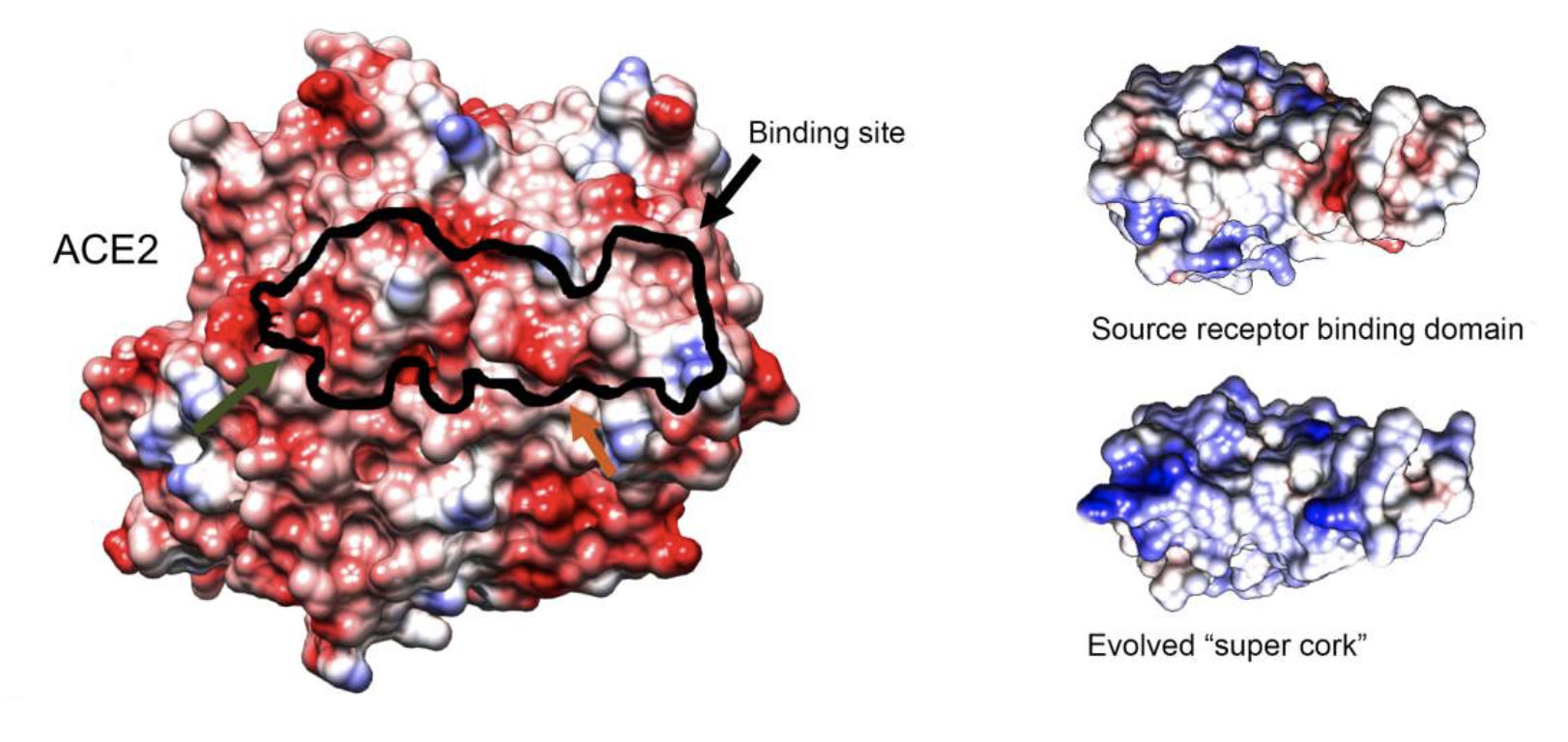 Structure d’un récepteur ACE2 (à gauche), du domaine de liaison d’origine (en haut à droite) et du « super bouchon » nouvellement conçu (en bas à droite), imagés par microscopie électronique cryogénique réalisée par le Dr Nadav Elad du Département de Soutien à la Recherche Chimique de Weizmann et le Dr. Orly Dym du Département des Sciences de la Vie Core Facilities. Le contour noir indique le site de liaison du « super liège » sur le récepteur ACE2.
Structure d’un récepteur ACE2 (à gauche), du domaine de liaison d’origine (en haut à droite) et du « super bouchon » nouvellement conçu (en bas à droite), imagés par microscopie électronique cryogénique réalisée par le Dr Nadav Elad du Département de Soutien à la Recherche Chimique de Weizmann et le Dr. Orly Dym du Département des Sciences de la Vie Core Facilities. Le contour noir indique le site de liaison du « super liège » sur le récepteur ACE2.
Finalement, le Dr Zahradník a isolé un petit fragment de protéine avec une capacité de liaison 1 000 fois plus forte que celle du domaine de liaison d’origine à partir duquel il a évolué. Ce « super bouchon » non seulement allait à l’ACE2 comme un gant, mais il a également été prouvé par Maya Shemesh et Shir Marciano, doctorants dans le laboratoire du Professeur Schreiber, que ce « super bouchon » n’affectait pas l’activité enzymatique de l’ACE2 – exactement comme les chercheurs l’avaient prévu. De plus, en raison de la forte liaison, il suffit de très faibles concentrations de la molécule nouvellement modifiée pour empêcher la liaison du virus à l’ACE2 et donc obtenir l’effet de blocage souhaité.
Pour développer une méthode potentielle d’administration de la nouvelle molécule en tant que médicament, le Professeur Schreiber et son équipe ont collaboré avec le professeur Yinon Rudich du Département des Sciences de la Terre et des Planètes de l’Institut Weizmann. En collaboration avec le Dr Ira Marton et le Dr Chunlin Li, ils ont créé un spray à base d’aérosol qui permettrait à la molécule développée d’être administrée par inhalation aux patients.
Au stade actuel, la formulation développée à l’Institut Weizmann a été testée à l’Institut National de la Santé (États-Unis), sur des hamsters infectés par le SRAS-CoV-2. Les résultats préliminaires indiquent que ce traitement réduit considérablement les symptômes de la maladie, suggérant qu’il pourrait s’agir d’un médicament potentiel. D’autres études précliniques sont prévues à l’Institut National de la Santé, dans un proche avenir.
Entretien avec le Pr Michel Goldberg
Pour mieux comprendre, Michel Godlberg, Professeur émérite à l’Institut Pasteur, Président du Conseil scientifique de Weizmann France et Membre honoraire du Conseil Pasteur-Weizmann, répond à nos questions.


