28 Mai Aider les cellules immunitaires du cerveau à retrouver leur état fondamental
Les réponses de la microglie sont rapides et ciblées grâce à un agent anti-inflammatoire
La microglie est un ensemble de cellules aux prolongements longs, fins et ramifiés, et disposée en formations denses dans les profondeurs des tissus cérébraux. Les images classiques obtenues jusqu’ici indiquaient aux chercheurs qu’elle restait tranquillement immobile, le long d’autres cellules non neuronales, comme une sorte de « glue » ou un ensemble de cellules gliales. Mais en réalité, les chercheurs ont récemment découvert que la microglie, composée en fait de cellules immunitaires, est toujours très occupée à analyser ses voisins, à façonner les synapses et à se débarrasser des cellules mortes. Une nouvelle étude de l’Institut Weizmann des Sciences apporte de fascinantes nouvelles informations sur la façon dont la microglie retrouve son calme après s’être brièvement enflammée pour répondre à un défi.
« Comme la plupart des problèmes neurologiques, de la SLA (sclérose latérale amyotrophique) à la schizophrénie en passant par la maladie d’Alzheimer, impliquent le besoin de laisser la microglie tranquille, nous pensons que comprendre le retour au calme d’une réponse est aussi important que son démarrage, » dit l’auteur principal de cette étude, le professeur Steffen Jung du Département d’Immunologie.
 (de gauche à droite) Jung-Seok Kim, le professeur Steffen Jung et Anat Shemer
(de gauche à droite) Jung-Seok Kim, le professeur Steffen Jung et Anat Shemer
Quand la microglie met en place une réponse immunitaire, c’est une poussée brutale et rapide qui implique des changements de l’expression de milliers de gènes. Mais qu’est-ce qui stoppe ensuite cette réponse, permettant aux cellules de retrouver leur état normal de repos ? Comme la microglie appartient aux cellules appelées macrophages – les « gros mangeurs » qui dévorent les substances ou cellules indésirables dans de nombreux tissus corporels – le professeur Jung et son équipe ont supposé que leur arrêt pourrait impliquer une substances anti-inflammatoire appelée interleukine 10 (IL-10). En effet, dans de précédentes études, ils avaient démontré que l’IL-10 joue un rôle dans la régulation des macrophages des intestins. Bien que la microglie vive extrêmement longtemps et soit très calme, contrairement aux macrophages des intestins qui vivent peu de temps et sont très vifs, certaines expériences de l’équipe démontrent que ces deux types de cellules utilisent les mêmes outils pour fonctionner.
« Nous avons comparé ces cellules à des atomes, qui tendent à revenir à leur » état fondamental » après leur excitation, » dit le professeur Jung. « Mais les atomes le font d’eux-mêmes tandis que la microglie a besoin d’une aide extérieure pour retrouver son calme après avoir été » excitée « . »
L’équipe de recherche, comprenant Anat Shemer, Gal Ronit Frumer et d’autres membres du laboratoire du professeur Jung, a travaillé en collaboration avec l’équipe de recherche du docteur Kiavash Movahedi de l’Université de Bruxelles ; elles ont créé des souris chez lesquelles il est possible de contrôler les signaux de l’IL-10 juste dans le cerveau. Quand elles ont enlevé le récepteur de l’IL-10 sur la microglie, les souris semblaient normales – tant qu’elles n’étaient pas en contact avec des lipopolysaccharides (LPS), un composant de la membrane des cellules bactériennes connu pour provoquer une réaction immunitaire extrême appelée orage cytokinique et activer la microglie. La microglie de ces souris génétiquement modifiées ne sont pas capables de détecter l’IL-10, elles restent donc dans leur état « excité » et les souris finissent par développer des signes de maladies neurologiques. L’IL-10 joue donc un rôle important dans le cerveau, ramenant la microglie active à son état normal, calme, indispensable à la santé.
Des sources d’IL-10 surprenantes
L’équipe de recherche s’est ensuite demandé d’où venait l’IL-10. Leurs expériences ont montré que cette cytokine n’était pas produite par la microglie elle-même mais par d’autres cellules immunitaires. Cependant, la microglie excitée produit une autre substance, le TNF qui provoque l’inflammation. Ainsi, quand la microglie ne détecte pas l’IL-10 à cause de son récepteur manquant, les cellules deviennent hyperactives, surproduisent du TNF entrainant des signes pathologiques chez les animaux. En revanche, les souris dont la microglie ne produit pas de TNF et n’a pas de récepteur à IL-10 ne présentent aucun signe d’inflammation ou de maladie. En d’autres termes, les chercheurs ont découvert la séquence d’évènements suivante : l’excitation de la microglie entraîne la production de TNF qui est délétère jusqu’à ce que sa production soit stoppée par l’IL-10 qui ramène la microglie à son état fondamental. Comme toujours, de nombreuses questions restent sans réponse : qu’arrive-t-il à ce circuit dans différents troubles neurologiques ? Pourquoi la microglie ne produit-elle pas sa propre substance la ramenant à son état fondamental comme le font d’autres macrophages comme ceux des intestins ?
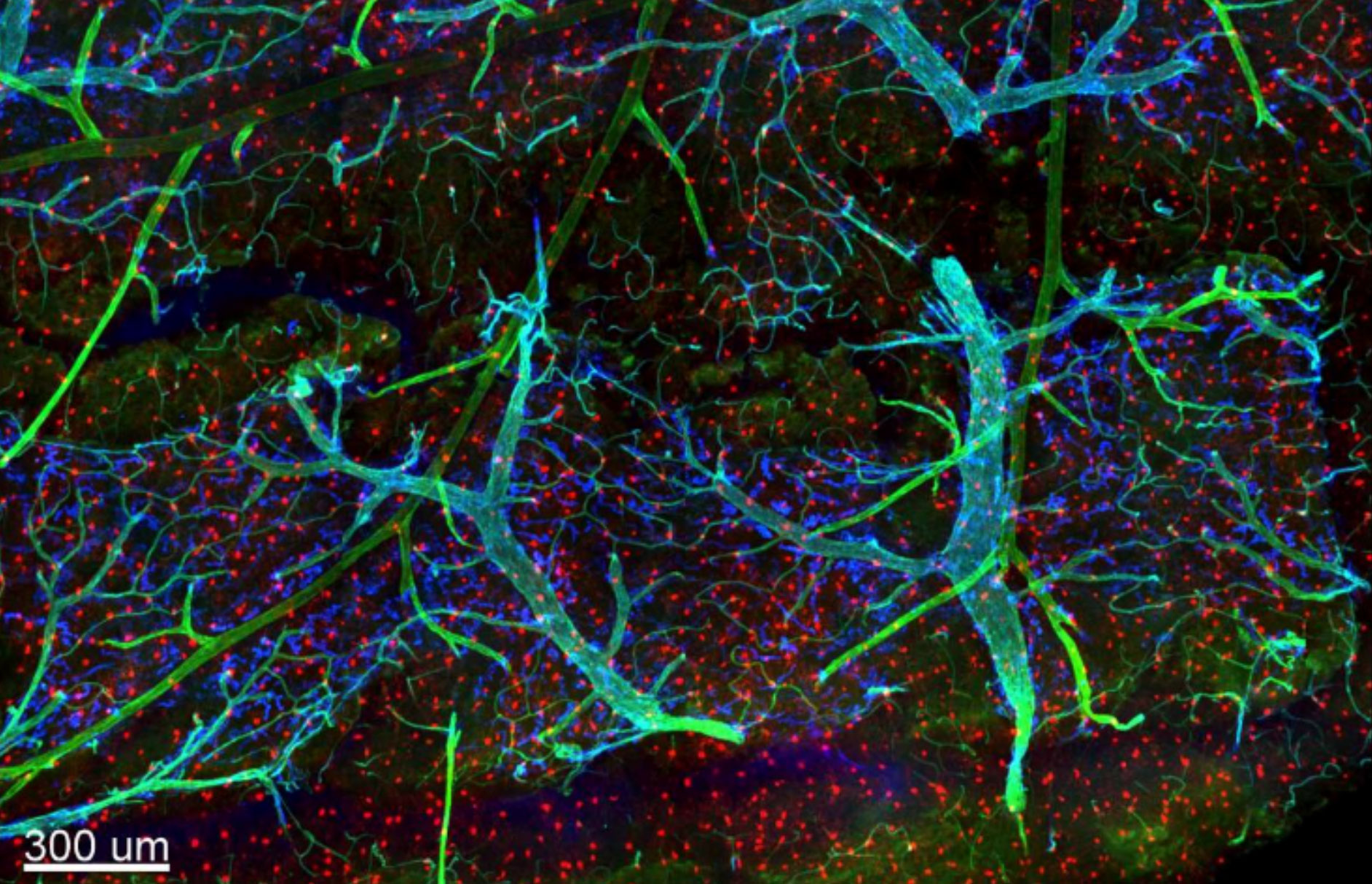
Les méninges et les tissus profonds dans le cerveau d’une souris : la microglie (en rouge) a une structure en cheveux caractéristique. Les vaisseaux sanguins sont en vert
Cette dernière découverte est une véritable surprise : d’autres laboratoires avaient indiqué que l’IL-10 était produite par la microglie quand elle était cultivée en laboratoire. La découverte qu’elle n’en produit pas quand elle est dans son milieu naturel, le cerveau, appuie l’idée que la microglie – et en réalité l’ensemble des macrophages – tire son identité des informations qu’elle perçoit dans son microenvironnement chose qu’on ne peut reproduire en laboratoire. Le professeur Jung suggère qu’il existe une raison au fait que la microglie ne produit pas d’IL-10 : cela permet à ses cellules de se focaliser entièrement sur la réponse et d’assurer un délai avant leur retour à leur état fondamental.
Partager la recombinaison
Pour leur étude sur l’IL-10, le professeur Jung et son équipe ont créé en laboratoire des souris chez lesquelles les récepteurs à IL-10 étaient absents chez les macrophages du cerveau mais présents chez ceux des intestins où l’absence de récepteur aurait provoqué de sévères colites. Cependant, les manipulations génétiques réalisées sur les souris de cette étude n’affectaient pas seulement les microglies mais plusieurs autres types de macrophages du cerveau y compris les cellules périvasculaires qui tapissent les vaisseaux sanguins. Pour s’attaquer à ce problème, Jung-Seok Kim, dans le laboratoire du professeur Jung, a déployé des efforts phénoménaux pour développer une approche permettant de manipuler les gènes d’un seul type de macrophages du cerveau, soit la microglie, soit les macrophages périvasculaires.
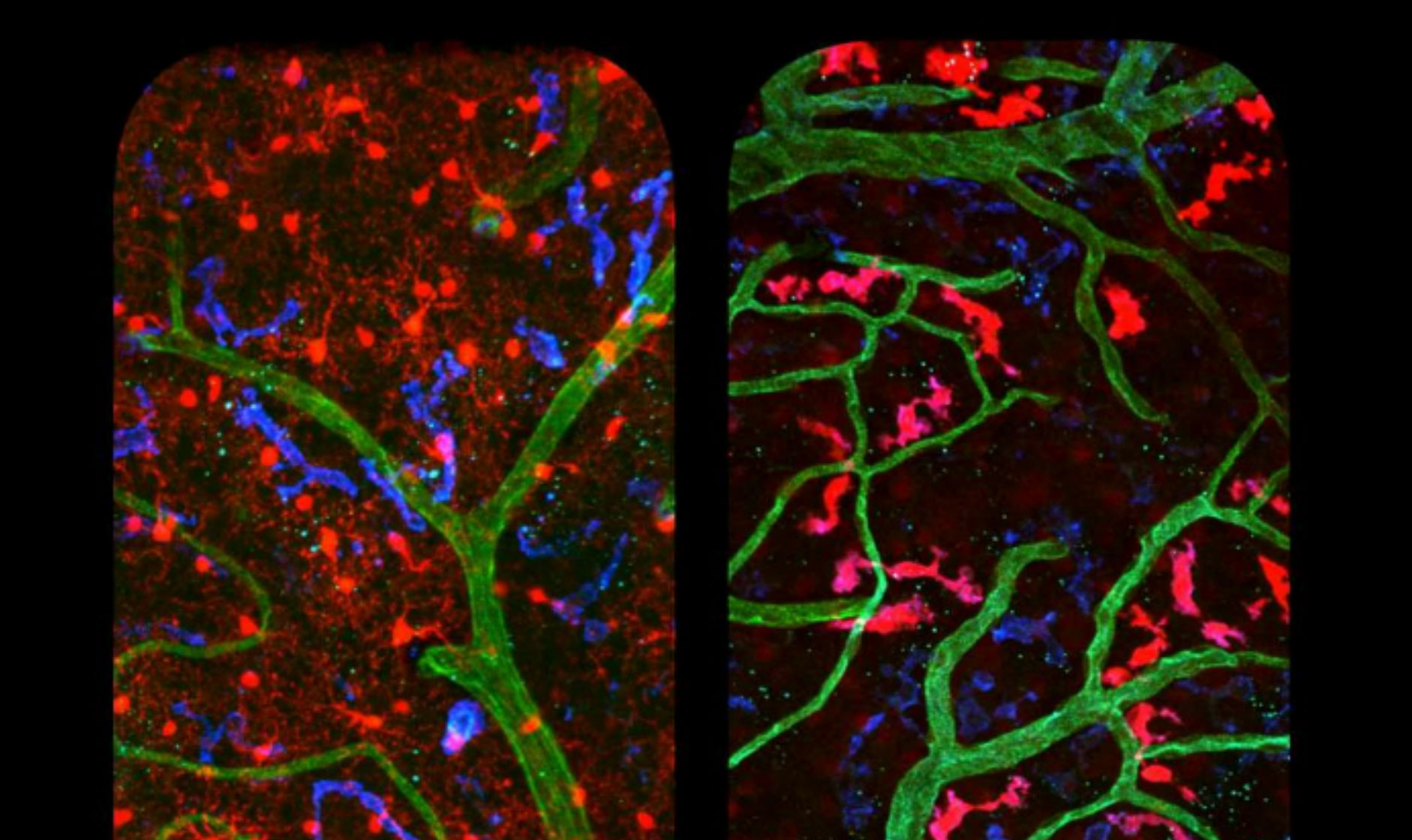
En rouge, la microglie (à gauche) et les macrophages périvasculaires (à droite) ont des formes et des localisations différentes
La méthode classique pour la manipulation des gènes chez les souris implique l’utilisation de Cre recombinase, une protéine qui, comme son nom l’indique, peut intervertir ou réarranger les gènes. Pour activer cette recombinase, les chercheurs la lient à des promoteurs dans le génome qui fonctionnent comme des interrupteurs « marche » et permettent aux chercheurs de contrôler le timing, la localisation et le niveau de modification du gène. Cependant, comme c’est le cas chez les macrophages du cerveau, les activités des promoteurs sont rarement spécifiques à un type de cellule. Le professeur Jung et son équipe ont décidé de séparer la recombinase en deux moitiés, chacune incapable d’agir seule. Cela leur a permis de placer chaque partie sous le contrôle d’un interrupteur particulier qui différencie la microglie et les macrophages périvasculaires dans le cerveau. Quand les deux promoteurs d’un type cellulaire donné sont activés, les fragments de recombinase s’assemblent en une enzyme active, donnant aux chercheurs un outil leur permettant d’altérer un seul type de cellule immunitaire cérébrale à la fois.
Dans le premier rapport sur leur modèle, une collaboration avec le docteur Pablo Blinder de l’Université de Tel Aviv et avec le docteur Kiavash Movahedi de l’Université de Bruxelles, l’équipe de recherche a découvert que ces deux types de cellules cérébrales vivaient dans différents environnements mais avaient également des formes distinctes et prenaient en charge différentes fonctions. Avec cette méthode, les chercheurs peuvent maintenant étudier comment les cellules périvasculaires, les premières à répondre aux messages transmis par le flux sanguin, et les microglies calmes et tranquilles communiquent et coordonnent leurs activités. Le professeur Jung et son équipe pensent que d’autres équipes de recherche vont adopter cette méthode pour étudier le rôle exact de différentes cellules immunitaires et concevoir par la suite des traitements pour ce genre de déséquilibre chez des cellules de ce type en particulier.
Le professeur Steffen Jung dirige la Plateforme Technique Kleinman sur le Cancer de tri cellulaire. Ses recherches sont financées par l’institut pour l’Immunologie Humaine Morris Kahn, le Fonds pour la Biologie Maurice et Vivienne Wohl, la Fondation Roland N. Karlen et la Fondation Blythe Brenden-Mann. Le professeur Jung est détenteur de la chaire professorale pour l’Immunologie Henry H. Drake.


