24 Août Payer le Prix de la Protection
Un nouveau modèle de maladie auto-immune pourrait résoudre l’une des grandes énigmes de la médecine et permettre de répondre à certaines questions : pourquoi les lymphocytes T attaquent et pourquoi certains organes ne sont pas sujets aux maladies auto-immunes ?
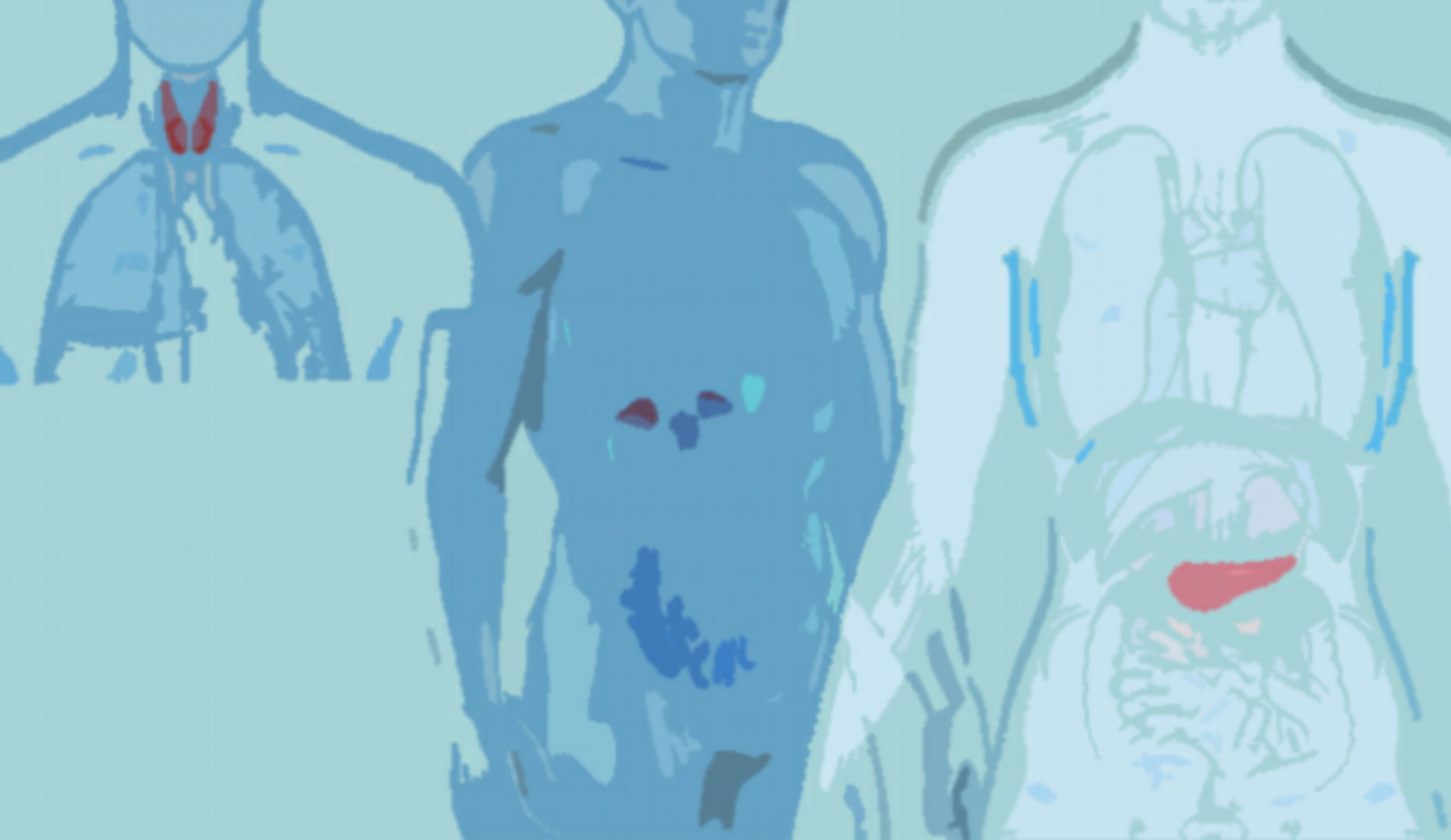
Les maladies auto-immunes mono-organe attaquent un organe précis comme la thyroïde, les glandes surrénales ou encore les cellules bêta du pancréas
Le meurtre gratuit des cellules dans le cas de maladies auto-immunes est-il une simple erreur d’identité ou les ordres viennent-ils d’un service physiologique important ? On admet généralement la première hypothèse – le fait que les attaques auto-immunes soient une forme d’erreur. Mais la seconde pourrait être plus proche de la vérité d’après un nouveau modèle proposé par des chercheurs de l’Institut Weizmann des Sciences. Le modèle suggère notamment une solution à l’une des énigmes de la médecine : pourquoi certains organes sont sujets aux maladies auto-immunes tandis que d’autres ne sont jamais touchés ? Les découvertes de cette étude sont aujourd’hui publiées dans Immunity.
Yael Korem Kohanim, étudiante-chercheur du laboratoire du professeur Uri Alon dans le département de biologie cellulaire et moléculaire, a dirigé cette étude.Elle explique que les maladies auto-immunes peuvent être divisées en deux types : les maladies auto-immunes systémiques, comme le lupus, qui attaquent plusieurs organes du corps, et les maladies auto-immunes d’organes, comme le diabète de type 1, qui ne touche qu’un organe. Une des interrogations que posent ces maladies auto-immunes d’organes est pourquoi elles touchent certains organes en en épargnant d’autres ? Le pancréas constitue un des exemple les plus frappants : les cellules bêta qui produisent l’insuline et qui composent 2 à 4% du pancréas sont particulièrement touchées tandis que le reste du pancréas n’est quasiment jamais touché par une maladie auto-immune. D’une façon similaire, la thyroïdite de Hashimoto affecte la thyroïde d’environ 7% de la population alors que la glande parathyroïde située juste à côté ne présente presque jamais de syndrome auto-immun. Ces maladies auto-immunes d’organes suivent un développement similaire. Elles apparaissent chez l’enfant ou le jeune adulte (contrairement aux maladies génétiques qui se manifestent dès la naissance ou aux maladies liées au vieillissement) et impliquent la destruction de cellules sécrétant des hormones essentielles. Les cellules immunitaires appelées lymphocytes T identifient en quelque sorte ces cellules endocrines comme des cellules dangereuses et les éradiquent.
Korem Kohanim, le professeur Alon et leur équipe de recherche composée notamment d’Avichai Tendler et d’Avi Mayo, et le professeur Nir Friedman du département d’immunologie se sont posés la question suivante : et si les lymphocytes T étaient conçus pour tuer ces cellules depuis toujours ?
Maintenir une offre adaptée à la demande
Les chercheurs ont émis l’hypothèse que les lymphocytes T restent « en fonction » comme une couche de protection supplémentaire, s’assurant que la quantité d’hormones reste dans des limites normales. Les hormones – insuline, hormones thyroïdiennes, cortisol – ont tendance à fonctionner selon des boucles de rétroaction, un manque d’hormones étant aussi néfaste qu’un excès. Quand la demande pour une hormone augmente – par exemple, une demande d’insuline quand du glucose est détecté de façon répétée – les cellules augmentent leur production et accélèrent la division cellulaire pour aider à répondre à cette demande. Mais la division cellulaire présente des risques : un certain pourcentage de cellules est susceptible de comporter des mutations. La plupart de ces mutations sont sans danger, mais si l’une d’elle perturbe le mécanisme précis de détection cellulaire, la cellule va se tromper dans la lecture de la demande qu’elle va percevoir comme élevée alors qu’elle est faible. Et le résultat est mortel : la cellule va continuer de produire des hormones en excès, se diviser encore et encore afin de produire de nouvelles cellules avec la même mutation qui vont également se diviser encore et encore et produire de plus en plus d’hormones provoquant rapidement de sévère maladies.
Les lymphocytes T – cellules immunitaires qui sélectionnent leurs cibles par l’identification de petites protéines caractéristiques des cellules qu’elles doivent tuer – peuvent vraisemblablement cibler les cellules qui sécrètent trop d’hormones dans des organes sains. Dans ce cas, ils agissent comme des agents secrets, détruisant les cellules qui menacent de prendre le dessus sur l’organe et sécréter trop d’hormones. Dans le cas des maladies auto-immunes, les lymphocytes T commenceront par accomplir cette mission mais finiront par faire du zèle et par tuer des cellules non mutantes.
Cette hypothèse est-elle plausible ?
Korem Kohanim, le professeur Alon et leur équipe ont commencé à fouiller dans la littérature et les bases de données bio-informatiques concernant les maladies auto-immunes d’organes. Ils ont alors imaginé un modèle mathématique représentant le fonctionnement d’organes sains dans lesquelles un petit nombre de lymphocytes T garantissent un taux d’hormone normal. Dans ce modèle, les organes restent sains et fonctionnels tant que les lymphocytes T ont les moyens d’être très sélectifs dans leurs cibles qui sont alors, pour la plupart, des cellules mutantes. Ce résultat est cohérent avec les découvertes des différentes études sur les maladies, qui montrent que les lymphocytes T identifient les protéines spécialement liées à la production ou la sécrétion d’hormones dans les cellules cibles. Pour les organes sains, ces lymphocytes T peuvent utiliser ce même mécanisme d’identification pour cibler n’importe quelle cellule produisant trop d’hormones. En d’autres termes, les maladies auto-immunes pourraient être le résultat d’un compromis : une couche de régulation empêche les maladies liées à une surproduction d’hormones induisant le risque inverse chez certaines personnes – une production réduite.
Ces glandes qui refusent de payer le prix
Si certaines glandes ne sont pas sensibles aux maladies auto-immunes, sont-elles bien protégées par des lymphocytes T ? L’équipe s’est replongée dans la littérature scientifique et a découvert que la parathyroïde, par exemple, est fortement sujette à une croissance non cancéreuse appelée adénome qui touche une femme ménopausée sur 50. Ces adénomes sécrètent de grandes quantités d’hormones provoquant une maladie appelée hyperparathyroïdie. D’autres exemples, moins dramatiques que les adénomes parathyroïdiens, appuient aussi l’idée qu’un manque d’action de la part des lymphocytes T, comme le suppose le modèle, pourrait provoquer une sécrétion d’hormones et une croissance cellulaire non contrôlées.
« Le modèle explique un certain nombre de découvertes déroutantes, » dit Korem Kohanim. « ainsi, nous avons étudié les séquences génétiques de lymphocytes T chez des individus sains et avons remarqué que certains d’entre eux possédaient cependant exactement le même récepteur identifiant les protéines que les lymphocytes T trouvés chez des patients souffrant de maladies auto-immunes. L’explication en a toujours été que les personnes apparemment en bonne santé avaient en fait une forme modérée de la maladie ou qu’ils en étaient aux premiers stades. Mais ces découvertes sont beaucoup plus logiques si l’on admet que ces lymphocytes T auto-réactifs sont censés être présents pour empêcher les maladies causées par une division cellulaire et une production d’hormones excessives. »
Des lymphocytes T humains comme ceux-ci pourrait être les « agents secrets » de certains organes, qui maintiennent la production d’hormones à un niveau normal
Jusqu’à présent, dit Korem Konahim, notre modèle apporte une solution à une énigme qui a longtemps tourmenté les chercheurs, cependant des expérimentations sont nécessaires pour confirmer sa véracité. Mais notre modèle a déjà attiré l’attention de scientifiques de ce domaine et a entraîné des discussions entre les plus grands immunologistes du monde. L’équipe du laboratoire du professeur Alon a collaboré avec l’équipe du professeur Nir Friedman du département d’immunologie et leur collaboration continue afin de tester expérimentalement les résultats de leur modèle.
« Nous pensons que les maladies auto-immunes ne sortent pas de nulle part mais constituent un dysfonctionnement d’un système physiologique déjà présent, » dit-elle. « Nous marchons dans les pas des pionniers de l’Institut Weizmann, Irun Cohen, Michal Schwartz et leurs étudiants, qui ont montré que le système immunitaire s’occupait de notre corps et combattait en même temps les agents pathogènes, » dit le professeur Alon. « J’ai hâte de voir si cette théorie permettra d’imaginer de nouvelles expériences qui nous fourniront des informations sur le mystère des maladies auto-immunes. »
Les recherches du professeur Uri Alon sont financées par l’Institut Sagol pour la recherche sur la longévité, le centre de recherche des sciences de la vie Jeanne et Joseph Nissim, le centre Braginsky pour l’interface entre sciences et humanités, le centre de recherche de la famille Kahn pour la biologie des systèmes de cellules humaines, le programme Zuckerman STEM Leadership, la fondation Rising Tide, la succession Olga Klein-Astrachan et le conseil européen pour la recherche. Le professeur Alon est détenteur de la chaire professorale Abisch-Frenkel.
Les recherches du professeur Nir Friedman sont financées par l’Institut de la famille David et Fela Shapell pour les études précliniques, le fonds de dotation du docteur Dvora et Haim Teitelbaum, la fondation Pearl Welinsky Merlo et son fonds pour la recherche sur le progrès scientifique, le fonds Florence Blau, Morris Blau et Rose Peterson, la fondation Rising Tide, la fiducie de bienfaisance Park Avenue, Gertrude Comninos, la succession Robert Einzig et la succession Emile Mimran. Le professeur Friedman est détenteur de la chaire professorale Eugene et Marcia Applebaum.


