03 Juil Le Master Switch qui transforme les cellules immunitaires en agents d’éradication du cancer
Des chercheurs du laboratoire du professeur Ido Amit identifient un gène qui reprogramme les macrophages en cellules « pro-cancer » et montrent comment le désactiver.
Pour se développer, les tumeurs cancéreuses doivent détourner le système immunitaire à leurs fins. L’une des principales astuces utilisées pour cela par la plupart des tumeurs consiste à manipuler un type de cellules immunitaires appelées macrophages, les amenant à protéger la tumeur du reste du système immunitaire, à recruter des vaisseaux sanguins et à favoriser la propagation du cancer à d’autres tissus. Aujourd’hui, les chercheurs du laboratoire du professeur Ido Amit à l’Institut Weizmann des Sciences ont utilisé des technologies de pointe en matière d’édition génique, de cellules uniques et d’intelligence artificielle pour identifier un interrupteur principal qui transforme les macrophages en alliés du cancer. Sur la base de cette découverte, l’équipe a mis au point une nouvelle thérapie qui s’est révélée efficace chez des souris atteintes de tumeurs de la vessie, l’un des types de cancer les plus courants chez l’homme et pour lequel les innovations thérapeutiques sont actuellement limitées. Cette découverte est présentée dans un article publié dans la revue Cancer Cell.
« Les macrophages sont des cellules très polyvalentes, une sorte de « couteau suisse » du système immunitaire, capables d’activer plusieurs types de fonctions pour différentes tâches et dans différentes situations », explique le Prof. Amit, membre du Département d’Immunologie Systémique de l’Institut Weizmann. Ces cellules ont le potentiel d’éradiquer le cancer de manière très efficace en remplissant de multiples fonctions antitumorales, telles que favoriser l’inflammation anticancéreuse ou alerter le reste du système immunitaire des dangers posés par les cellules tumorales. C’est précisément la raison pour laquelle la plupart des cancers solides ont besoin de convertir les macrophages à leur cause pour se développer. « Ce faisant, les tumeurs se protègent du côté « méchant » des macrophages, et activent également les fonctions des macrophages qui les aident à se développer, telles que la suppression de l’activité d’autres types de cellules immunitaires et la stimulation de la croissance des vaisseaux sanguins pour fournir de l’oxygène à la tumeur. »

(g-d) Dr. Ken Xie, Dr. Fadi Sheban and Dr. Truong San Phan
En effet, des études récentes ont révélé un lien étroit entre le mode d’activation des macrophages tumoraux (que ces cellules combattent la tumeur ou contribuent à sa croissance) et la survie des patients atteints de cancer. Compte tenu de cette importance, de nombreuses études ont cherché des moyens de reprogrammer les macrophages pour qu’ils retrouvent leur mode anticancéreux. « Ces efforts ont échoué parce qu’ils ont séparé les macrophages en deux catégories très générales : protumorales et antitumorales », explique le Prof. Amit. « Aujourd’hui, nous savons que cette catégorisation passe à côté d’une grande partie de la complexité de la fonction des macrophages. »
La nouvelle étude, dirigée par le Dr Fadi Sheban, a adopté une approche plus nuancée pour analyser les fonctions des macrophages. « Nous avons commencé la recherche en analysant des ensembles de données de macrophages provenant d’échantillons de tumeurs humaines et en examinant les nombreuses fonctions différentes de ces cellules », explique le Dr Sheban. « Cette analyse nous a permis d’identifier 120 gènes soupçonnés de jouer un rôle dans l’activation des diverses fonctions protumorales des macrophages. »
L’étape suivante consistait à développer un système capable de cribler ces 120 gènes potentiels pour identifier les gènes les plus importants dans la capacité de la tumeur à détourner l’activité des macrophages. Le Prof. Amit et son équipe se sont appuyés sur leurs technologies avancées de cellules uniques, capables d’étudier la fonction cellulaire à l’échelle de la cellule unique, en combinaison avec l’édition génique CRISPR-Cas9. La technologie combinée leur a permis de supprimer un à un les gènes individuels des macrophages dans un seul macrophage, à partir de la liste des gènes suspects, et de voir comment cela modifiait les propriétés et la fonction du macrophage à l’échelle de la cellule unique.
« Grâce à notre nouvelle plateforme, nous avons pu étudier les effets des 120 gènes suspects sur le fonctionnement des macrophages individuels. Cette phase de l’étude a consisté à séquencer plus de 100 000 macrophages modifiés au total », explique Sheban.

Prof. Ido Amit
Il en a résulté un ensemble de données détaillées sur la manière dont les différents commutateurs régulateurs activent ou désactivent diverses fonctions des macrophages. « C’était un vrai fouillis. Au début, nous ne pouvions pas dire quels gènes étaient les plus importants et quelle activité des macrophages ils contrôlaient », se souvient le Dr. Sheban. Pour donner un sens aux données empiriques, le Prof.Amit et son équipe ont utilisé un outil informatique d’apprentissage profond développé par un collègue du département, le professeur Nir Yosef. Cet outil, appelé MrVI, a permis de simplifier les données en une carte fonctionnelle montrant à la fois comment les différents commutateurs de régulation, chacun représenté par un point sur la carte, influencent les fonctions des macrophages et à quel point les effets des différents régulateurs sont similaires les uns aux autres.
« Grâce à MrVI, nous avons pu comprendre quelles délétions génétiques modifiaient les fonctions des macrophages de manière à les faire combattre la tumeur », explique le Dr. Sheban.
Un gène, appelé Zeb2, s’est démarqué sur la carte, car il modifiait complètement les activités de soutien des tumeurs des macrophages. Ce gène n’avait jamais été étudié auparavant dans les macrophages tumoraux. « Nous avons compris qu’un macrophage avec un Zeb2 active toutes les fonctions pro-tumorales et désactive tous les programmes anti-tumoraux, et que le fait de faire taire ce gène permet d’obtenir exactement le contraire », ajoute le Dr. Sheban. « En d’autres termes, nous avons trouvé l’interrupteur principal pour reprogrammer les macrophages afin qu’ils combattent le cancer. »
Des recherches plus approfondies sur le gène ont montré que la protéine codée par Zeb2 agit en modifiant la structure physique du génome, appelée épigénome, déterminant ainsi quels autres gènes seront « ouverts », c’est-à-dire disponibles pour la traduction en protéines, et lesquels seront inactifs, ou « fermés ». « Zeb2 ouvre tous les gènes pro-tumoraux dans les macrophages et ferme tous les gènes antitumoraux. En le supprimant, nous pouvons obtenir l’effet inverse », explique le Dr. Sheban.

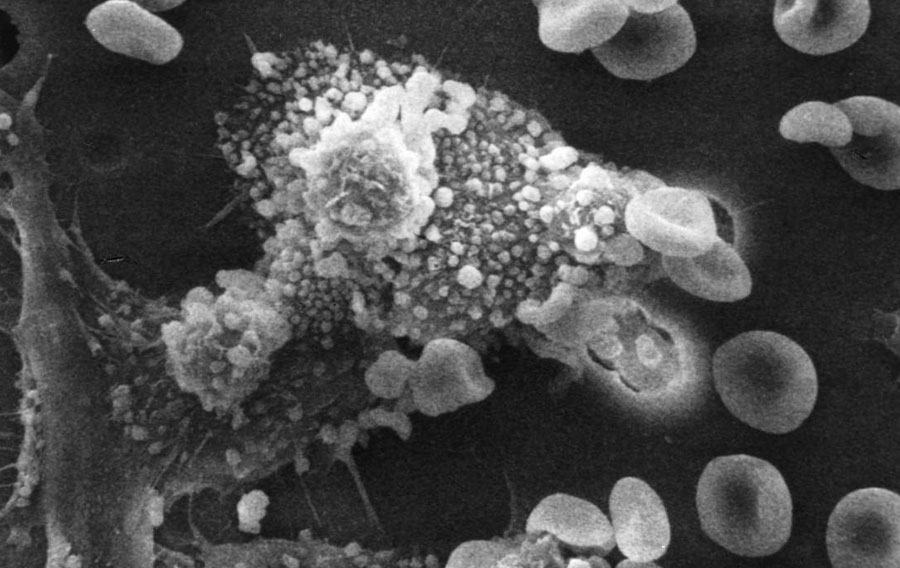
Macrophages tuant une cellule cancéreuse. Photo de Susan Arnold et Raowf Guirguis / National Cancer Institute
Des expériences menées sur des cultures de tissus et des souris ont montré que rendre Zeb2 silencieux convertit les macrophages en mode antitumoral. « Nous avons également analysé les données de patients humains et constaté que les patients présentant une forte expression de Zeb2 courent un risque beaucoup plus élevé de développer un cancer plus agressif. »
L’étape suivante a consisté à essayer de transformer cette découverte en une thérapie potentielle. Pour ce faire, Amit et son équipe ont collaboré avec le professeur Marcin Kortylewski du City of Hope National Medical Center en Californie, aux États-Unis, qui a mis au point une molécule d’ADN unique conçue pour se fixer aux macrophages et être avalée par eux. « Nous avons utilisé cette molécule comme appât et l’avons reliée à une petite molécule d’ARN silenceur. Une fois avalée par le macrophage, la molécule d’ARN fait taire spécifiquement le gène Zeb2 », explique le Dr. Sheban. Les chercheurs ont utilisé cette nouvelle molécule pour traiter des souris atteintes d’un cancer de la vessie : ils ont injecté la molécule dans la zone tumorale et ont constaté que la thérapie reprogrammait les macrophages pour combattre la tumeur, et que les tumeurs rétrécissaient considérablement. « L’objectif est maintenant de développer cette approche pour en faire un nouveau traitement contre le cancer chez l’homme », résume le Prof. Amit. « Notre étude a également démontré comment les technologies de pointe peuvent fournir une compréhension approfondie et à haute résolution du fonctionnement des différents acteurs du système immunitaire dans différentes maladies, et comment cette compréhension a le potentiel de devenir le fondement de nouvelles thérapies pour les patients. »


