01 Sep Un nouveau mécanisme immunitaire révélé dans les déchets cellulaires
Cette découverte est prometteuse compte tenu de la résistance croissante des bactéries aux antibiotiques.
Tout comme les humains produisent des montagnes de déchets, nos cellules éliminent constamment les protéines endommagées ou devenues inutiles. Le système d’élimination des déchets cellulaires, appelé protéasome, est surtout connu pour son rôle central dans la dégradation et le recyclage des protéines, mais dès les années 1990, il a été démontré que les produits de ce processus – de courtes séquences protéiques appelées peptides – peuvent être exposées à la surface des cellules, aidant ainsi le système immunitaire à identifier les menaces. Dans une nouvelle étude publiée dans Nature, le laboratoire du professeur Yifat Merbl à l’Institut Weizmann des Sciences rapporte avoir découvert un mécanisme immunitaire surprenant impliquant le protéasome. L’équipe a découvert que certains des peptides libérés dans le protéasome lors de la dégradation des protéines sont capables de tuer les bactéries. Ces découvertes élargissent notre compréhension des défenses innées de l’organisme et offrent un nouvel espoir pour lutter contre la menace croissante de la résistance des bactéries aux antibiotiques.

(g-d): Karin Goldberg, Einav Laser, Dr. Arseniy Lobov, Dr. Paola Antonello, Dr. Merav Shmueli and Prof. Yifat Merbl
Il y a plusieurs années, des scientifiques du laboratoire du Prof. Merbl, au sein du Département d’Immunologie Systémique de l’Institut Weizmann, ont mis au point une technologie innovante qui leur a permis de « fouiller dans les poubelles » du protéasome, une machine moléculaire complexe composée de nombreuses protéines. Grâce à cet outil avancé, les chercheurs ont suivi les protéasomes dans diverses pathologies, telles que le lupus et le cancer, accumulant ainsi de grandes quantités de données sur les fragments de protéines dégradées.
« Nous avons examiné toutes les données et nous nous sommes demandé si les produits de dégradation pouvaient jouer un rôle supplémentaire, au-delà de leur présentation au système immunitaire », explique le Prof. Merbl à propos du point de départ de la nouvelle étude. À leur grande surprise, les chercheurs ont découvert que bon nombre de ces produits de dégradation correspondaient à des séquences précédemment identifiées comme des peptides antimicrobiens, des composants essentiels du système immunitaire inné, qui constitue la première ligne de défense de l’organisme contre les bactéries, les virus et les parasites. On savait depuis des années que ces peptides pouvaient être générés par des enzymes qui coupent les protéines appelées protéases. Celles-ci « libèrent » les peptides des protéines pour qu’ils puissent devenir actifs, mais les nouvelles découvertes du laboratoire du Prof. Merbl ont montré que ces peptides pouvaient être activés par les protéasomes. En fait, l’étude a révélé que le protéasome lui-même produit constamment ces peptides dans le cadre de son activité de routine, et que cette production augmente considérablement lors d’infections bactériennes.
« Jusqu’à présent, nous ne savions rien du lien entre les produits du protéasome et la production de ces peptides », explique le Prof. Merbl. « À la lumière de nos découvertes, nous avons mené une série complète d’expériences démontrant que les protéasomes sont essentiels à ce système de défense. » Dans une expérience menée sur des cellules humaines, les chercheurs ont inhibé les protéasomes dans un groupe de cellules et les ont laissés intacts dans l’autre groupe ; lorsque les cellules ont été infectées par la salmonelle, les bactéries envahissantes se sont développées dans le groupe dépourvu de protéasomes actifs. Au contraire, les bactéries ne se développaient pas dans les cellules pourvues de protéasomes actifs. Dans une autre expérience, les bactéries se sont développées lorsque le protéasome fonctionnait normalement mais que les peptides produits en son sein étaient détruits.
L’efficacité des peptides a également été démontrée chez des souris infectées par des bactéries qui provoquent une pneumonie et une septicémie, une maladie potentiellement mortelle déclenchée par une réponse immunitaire à une infection grave. Les expériences menées sur ces souris ont montré que le traitement par un peptide dérivé du protéasome réduisait significativement le nombre de bactéries, diminuait les lésions tissulaires et améliorait même les taux de survie. Les résultats ont surpris les chercheurs pour deux raisons. Tout d’abord, ils ont montré qu’un seul peptide produit naturellement par l’organisme peut s’avérer efficace contre une maladie potentiellement mortelle lorsqu’il est administré en grande quantité. Ensuite, les résultats du traitement étaient comparables à ceux du traitement par des antibiotiques puissants utilisés en clinique.
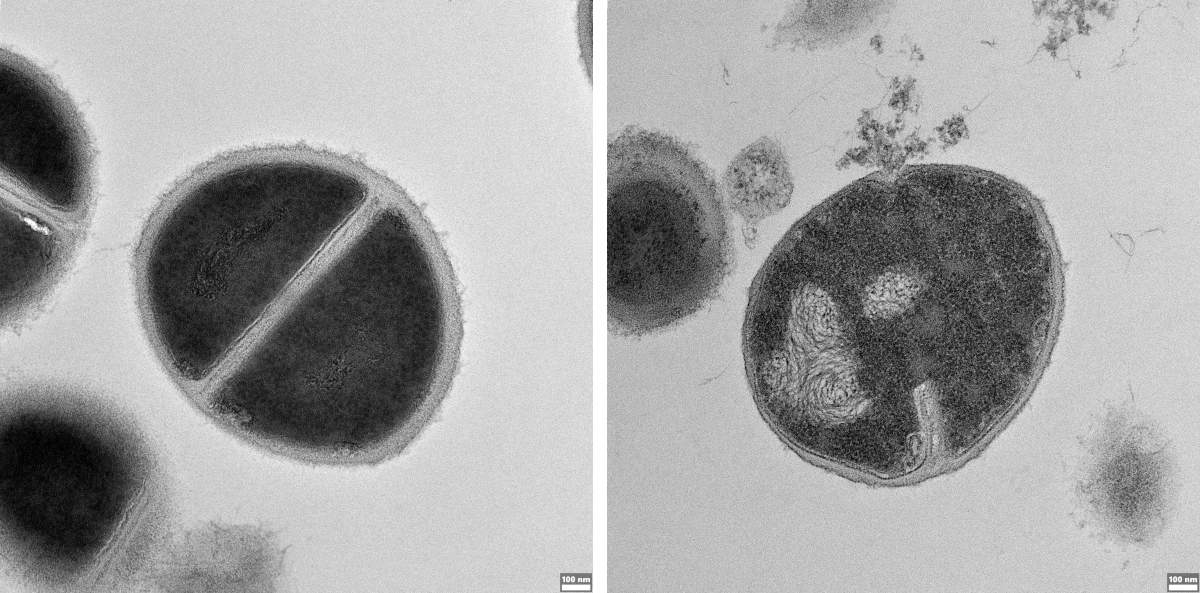
Bactérie Staphylococcus pouvant provoquer des infections humaines conduisant à une défaillance immunitaire. À gauche : culture de la bactérie non traitée. À droite : bactérie détruite par un peptide antimicrobien produit par le protéasome et découvert dans la nouvelle étude.
Les chercheurs ont toutefois été particulièrement enthousiastes lorsqu’ils ont réalisé que l’infection bactérienne mettait le protéasome en « mode turbo ». « Nous avons constaté que l’infection provoque un changement du mode de découpe des protéines par le protéasome, qui « favorise » la production de peptides aux propriétés antibactériennes », explique le Prof. Merbl.
Lorsque les chercheurs ont tenté d’expliquer la cause de ce changement, ils ont identifié, dans l’heure suivant l’infection, des protéasomes dotés d’une unité de contrôle appelée PSME3 et ont découvert que cette sous-unité était responsable de la priorisation de la production de ces peptides. Lorsqu’ils ont empêché les protéasomes d’utiliser cette sous-unité de contrôle, les bactéries ont été moins endommagées, ce qui souligne l’importance du protéasome dans la mise en place d’une première ligne de défense contre l’infection.
« La capacité à suivre l’évolution de l’activité du protéasome en réponse à une infection bactérienne reposait sur la technologie que nous avons développée il y a plusieurs années », explique Karin Goldberg, doctorante et responsable du projet. « Le tournant s’est produit lorsque nous avons constaté que l’activité de découpure des protéines par le protéasome changeait pendant l’infection. C’est à ce moment-là que nous avons réalisé que nous avions découvert un mécanisme immunitaire jusque-là inconnu. »
Les chercheurs se sont ensuite posé une question plus large : combien de peptides antimicrobiens pourraient se cacher dans les protéines humaines ? À l’aide d’un algorithme permettant d’analyser toutes les protéines produites par le corps humain, ils ont identifié des peptides ayant des propriétés antibactériennes potentielles dans 92 % des protéines humaines. Leurs simulations ont révélé plus de 270 000 peptides jusqu’alors inconnus qui pourraient être libérés par le protéasome, représentant un énorme réservoir inexploité d’agents antimicrobiens naturels.
« Cette base de données de peptides ouvre une nouvelle frontière pour le développement de traitements personnalisés contre les infections et d’autres pathologies », explique le Prof. Merbl. Par exemple, les peptides naturels pourraient être adaptés pour renforcer les défenses immunitaires des patients dont le système immunitaire est affaibli, comme les receveurs de greffes d’organes ou les patients atteints de cancer. De plus, alors que la résistance aux antibiotiques continue de poser un défi majeur en matière de santé publique, les résultats de l’étude non seulement redéfinissent notre compréhension de l’immunité cellulaire, mais ouvrent également la voie à des thérapies innovantes basées sur des mécanismes naturels.
Au-delà des implications cliniques, le Prof. Merbl affirme que la plus grande émotion a été de découvrir un mécanisme cellulaire fondamental qui est régulé par le protéasome et qui est différent de tout ce qui était connu auparavant : « Cette étude met en évidence la manière dont l’innovation technologique et la recherche fondamentale s’entremêlent de manière imprévisible. Sans la technologie qui nous a permis d’analyser les déchets cellulaires, nous n’aurions pas fait cette découverte, mais lorsque nous avons développé cette technologie, nous n’avons jamais imaginé que nous découvririons un nouveau mécanisme immunitaire. »
La Science en Chiffres
Les poubelles cellulaires – des complexes protéiques appelés protéasomes – représentent entre 1 et 2 % de la teneur en protéines d’une cellule. Elles sont responsables de la dégradation de 70 % des protéines cellulaires.


