01 Mai Un cœur brisé : deux types de cicatrices, deux voies de guérison
Une étude collaborative révèle deux types de cicatrices, dites chaudes et froides, dans les tissus cardiaques lésés, suggérant que les traitements doivent tenir compte du type de cicatrice.
Toutes les cicatrices ne sont pas égales. C’est la conclusion d’une nouvelle étude menée par des chercheurs de l’Institut Weizmann des sciences : ils ont découvert que deux types distincts de cicatrices, appelées « chaudes » et « froides », peuvent se former dans le cœur malade, et que ces deux types nécessitent des traitements totalement différents. Comme l’a rapporté Cell Systems, l’étude de l’Institut Weizmann pourrait conduire à des thérapies innovantes pour prévenir ou traiter les maladies cardiaques, et elle ouvre une nouvelle voie de recherche sur la fibrose (le développement de tissu cicatriciel en réponse à une blessure ou au cours du vieillissement) dans divers autres organes.
L’étude a commencé par une collaboration de quartier. Le professeur Eldad Tzahor, dont les recherches portent principalement sur la régénération du cœur, a découvert un modèle mathématique créé dans le laboratoire voisin, dirigé par le professeur Uri Alon. Le modèle du Prof. Alon suggérait de classer les cicatrices en fonction de la présence de deux types de cellules dans le tissu cicatriciel : les fibroblastes producteurs de collagène, qui créent un échafaudage fibreux, et les cellules immunitaires appelées macrophages.

(g-d) Prof. Eldad Tzahor, Shoval Miyara, Dr. Avi Mayo, Dr. Miri Adler and Prof. Uri Alon
« Au début, cela semblait trop simple – après tout, nous savons tous à quel point les systèmes biologiques sont complexes », se souvient le Prof. Tzahor. « Mais l’idée m’intriguait et je voulais depuis longtemps collaborer avec Uri. J’ai suggéré que nous essayions d’appliquer son modèle au cœur blessé. »
Le cœur est une pompe qui ne peut pas fonctionner s’il présente un trou, il commence donc immédiatement à réparer tout dommage, tel que celui résultant d’une crise cardiaque. Comme les cellules du muscle cardiaque ne se régénèrent pas, la réparation consiste à bricoler un patch de tissu cicatriciel. Le problème est que la cicatrice peut envahir les tissus cardiaques sains dans les jours ou les semaines qui suivent la crise cardiaque, interférant avec le fonctionnement normal du cœur. Le tissu cicatriciel, s’il bouche le « trou », ne se contracte pas efficacement, et comme le muscle cardiaque gravement cicatrisé continue à pomper du mieux qu’il peut, de nombreux patients finissent par développer une insuffisance cardiaque chronique.
Il n’existe actuellement aucun traitement efficace contre la cicatrisation cardiaque. Par conséquent, la prévention ou la réduction de la fibrose est un besoin médical urgent. Pourtant, malgré l’apparente simplicité du tissu cicatriciel, la fibrose est en réalité un processus extrêmement complexe impliquant de nombreux types de cellules et de molécules de signalisation.
Guidé par Picasso
« Pour essayer de comprendre cette complexité, nous nous sommes inspirés de Picasso », explique Shoval Miyara, doctorant en cotutelle des Prof. Tzahor et Alon, qui a dirigé le projet avec le Dr Miri Adler de l’Université hébraïque de Jérusalem, une ancienne étudiante du Prof. Alon. Shoval Miyara fait référence à l’analogie parfois établie entre les modèles mathématiques des systèmes biologiques et certains arts abstraits, comme le taureau de Pablo Picasso, immédiatement reconnaissable même s’il n’est dessiné qu’avec quelques lignes. « Nous voulions aller à l’essence de la fibrose cardiaque », explique Shoval Miyara.
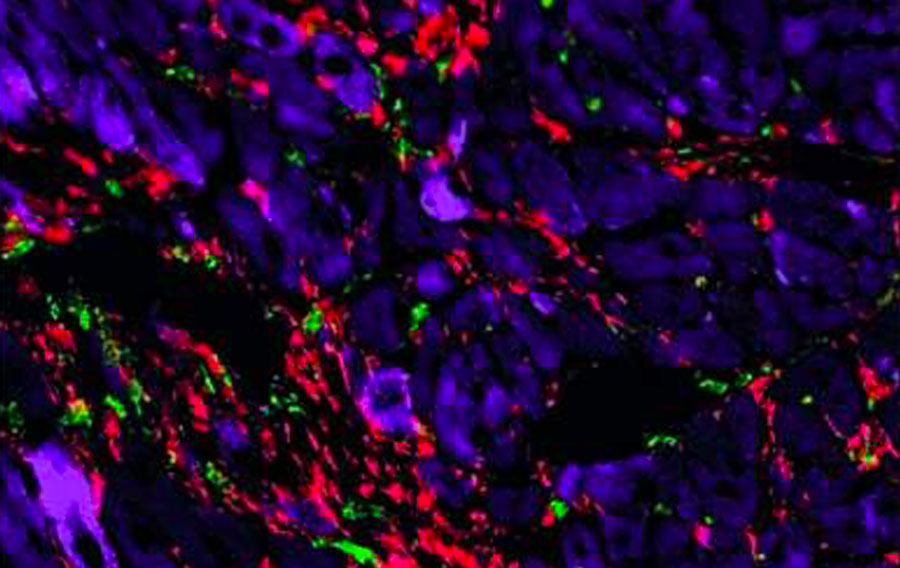
Lorsque lui et ses collègues ont appliqué le modèle mathématique du Prof. Alon au cœur blessé, les prédictions du modèle se sont écartées de l’image classique, qui traite toutes les cicatrices cardiaques de la même manière. Les prédictions indiquaient que dans certaines cicatrices, en plus des myofibroblastes – les fibroblastes actifs présents dans le cœur blessé – il y a de nombreuses cellules immunitaires appelées macrophages. La cicatrisation définie par la présence de ces deux populations cellulaires, qui dépendent d’un échange de molécules de soutien entre elles, a été nommée fibrose chaude, en référence métaphorique à la chaleur et à l’inflammation souvent associées à une réponse immunitaire. En revanche, d’autres cicatrices, appelées fibrose froide, contiendraient des myofibroblastes auto-entretenus mais presque pas de macrophages. Le modèle suggérait donc que les deux types de fibrose dans le cœur sont régis par des mécanismes différents.
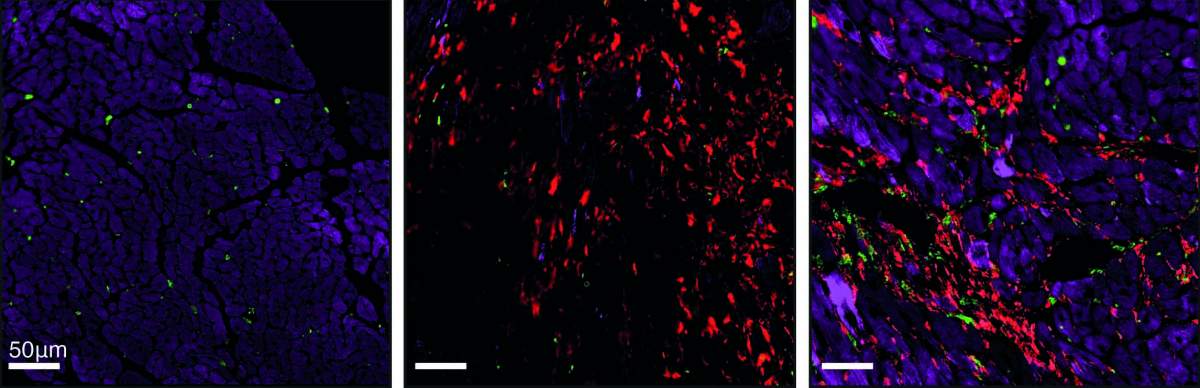
Une nouvelle image de la cicatrisation : tissu cardiaque de souris observé au microscope. Le tissu normal (à gauche) est constitué de cellules musculaires cardiaques (violet). Après une crise cardiaque (au centre), le tissu cicatriciel révèle une fibrose froide, constituée de myofibroblastes (rouge). En revanche, la cicatrice de l’insuffisance cardiaque (à droite) révèle une fibrose chaude, caractérisée par la présence de myofibroblastes et de macrophages (vert).
Lorsque Shoval Miyara et son équipe ont testé ces prédictions sur des cellules en culture et sur un modèle de souris génétiquement modifié qu’ils ont créé pour cette étude, ils ont découvert que, effectivement, les lésions cardiaques chroniques sont caractérisées par une fibrose chaude, tandis que les lésions aiguës, comme une crise cardiaque, conduisent à une fibrose froide. Bien que certaines cellules immunitaires soient présentes immédiatement après une crise cardiaque, il ne reste pratiquement plus de macrophages dans le tissu cicatriciel au bout de quelques semaines. Le même schéma s’est dégagé lorsque les scientifiques ont testé des échantillons de tissu cardiaque de patients humains.
« Les images microscopiques classiques des muscles cardiaques endommagés se ressemblent toutes : elles montrent généralement les fibres de collagène qui constituent le tissu cicatriciel », explique le Prof. Tzahor. « Mais en réalité, nous avons montré que la fibrose à chaud et à froid, qui sont dues à des mécanismes biologiques différents, doivent être traitées différemment. »
Cibler les responsables de la cicatrisation
En se concentrant sur les processus moléculaires régissant la fibrose froide, Shoval Miyara et ses collègues ont révélé les détails du mécanisme en boucle dans lequel les myofibroblastes sécrètent des molécules qui stimulent la fibrose. Les chercheurs ont identifié une molécule clé dans cette boucle : une protéine appelée TIMP-1, connue pour plusieurs fonctions, mais dont cette étude a montré pour la première fois qu’elle agissait comme un facteur de croissance facilitant la division des myofibroblastes et la fibrose cardiaque. Lorsque les scientifiques ont bloqué la TIMP-1 chez des souris après une crise cardiaque, le tissu cicatriciel qui s’est formé dans leur muscle cardiaque était plus petit que celui qui s’est formé chez les souris non traitées.

« Je voulais depuis longtemps collaborer avec Uri. » Prof. Tzahor (à gauche) et Prof. Alon
« Nous avons montré que la protéine TIMP-1 est une cible potentielle pour de futurs médicaments contre la fibrose, mais ce n’est clairement pas la seule », déclare Shoval Miyara. « Des recherches plus approfondies peuvent en révéler d’autres, montrant lesquelles pourraient être ciblées le plus efficacement pour prévenir ou minimiser les dommages au muscle cardiaque après une crise cardiaque. »
Le Prof. Tzahor résume : « Nous avons découvert que la fibrose cardiaque chaude et la fibrose cardiaque froide sont deux maladies cardiaques distinctes. Cela suggère que le développement de médicaments pour ces maladies pourrait devoir suivre deux trajectoires différentes. »
Et le Prof. Alon d’ajouter : « Cette collaboration m’a ouvert les yeux sur la biologie fascinante de la pompe sanguine du corps. J’espère qu’elle inspirera de nouvelles études à l’interface des modèles mathématiques, de la biologie fondamentale et des besoins cliniques. Les études futures pourront vérifier si le concept de fibrose chaude et froide s’applique aux cicatrices d’autres tissus, y compris ceux des poumons, des reins et du foie, ainsi qu’aux cicatrices résultant de diverses maladies, telles que le cancer et peut-être même les accidents vasculaires cérébraux. »
La Science en Chiffres
Le ventricule gauche d’un cœur humain contient environ 4 milliards de cellules musculaires cardiaques appelées cardiomyocites. Durant une crise cardiaque, il est estimé que 25% d’entre elles soit 1 milliard meurent


