
06 Mar Une nouvelle hypothèse sur l’hypophyse
Une étude de l’Institut Weizmann remet en question un vieux dogme concernant les origines embryonnaires de l’hypophyse et pourrait permettre de mieux comprendre le déficit en hormone de croissance et d’autres troubles hypophysaires.
Une observation inattendue a conduit des chercheurs de l’Institut Weizmann des Sciences à remettre en question une doctrine vieille de 200 ans concernant les origines embryonnaires de la glande pituitaire.
Situé à la base du cerveau, cet organe de la taille d’un petit pois, également appelé hypophyse, joue un rôle central dans le maintien du métabolisme de l’organisme. Interfacé entre le cerveau et le sang, il peut être décrit comme le centre de contrôle du système endocrinien, qui libère des hormones dans la circulation sanguine. Les résultats de cette nouvelle étude, menée dans le laboratoire du professeur Gil Levkowitz des Départements de Biologie Cellulaire Moléculaire et de Neurosciences Moléculaires de Weizmann, pourraient améliorer notre compréhension de l’interaction entre les différentes cellules de l’hypophyse et jeter un nouvel éclairage sur les troubles de la glande.
La structure de l’hypophyse, qui comprend deux lobes distincts remplissant des fonctions physiologiques différentes, a été fortement conservée au cours de l’évolution, ce qui signifie que les glandes hypophysaires du poisson, de la souris et de l’homme sont largement similaires. Pendant de nombreuses années, les chercheurs se sont intéressés de près à une question fondamentale : A quel moment les deux lobes apparaissent au cours du développement embryonnaire ?

(l-r) Prof. Gil Levkowitz, Dr. Dena Leshkowitz, Prof. Ido Amit and Qiyu Chen
L’embryon au stade précoce est constitué de trois couches cellulaires primaires, à partir desquelles le corps entier se forme : l’endoderme (couche interne), le mésoderme (couche intermédiaire) et l’ectoderme (couche externe). Jusqu’à présent, l’opinion généralement admise était que les cellules constituant chacun des deux lobes de l’hypophyse provenaient de subdivisions embryonnaires distinctes de l’ectoderme. On pensait que le lobe frontal, ou antérieur, qui libère six hormones majeures – dont les hormones de stimulation thyroïdiennes et l’hormone de croissance – provenait uniquement de la couche de tissu extérieur de l’embryon au stade précoce, l’ectoderme oral. Le lobe postérieur, qui libère deux hormones majeures dérivées du cerveau – l’ocytocine, qui régule la reproduction et le comportement, et la vasopressine, qui contrôle divers aspects de l’équilibre des fluides corporels – était considéré comme provenant de l’ectoderme neural, un tissu qui finit par former également le système nerveux. Cette subdivision a été introduite pour la première fois en 1838 par Martin H. Rathke, un embryologiste allemand pionnier, et elle a été étayée par des études ultérieures.
Mais lorsque Qiyu Chen, étudiante en doctorat, a décidé de réexaminer la théorie de Rathke sur l’origine de l’hypophyse, elle a remarqué quelque chose qui allait à l’encontre des attentes. Profitant de nouvelles méthodologies génétiques et d’imagerie auxquelles les chercheurs précédents n’avaient pas accès, Qiyu Chen a pu marquer diverses cellules dans le tissu ectodermique d’un embryon de poisson zèbre et retracer visuellement ce qu’il est advenu des progénitures de ces cellules au fur et à mesure que l’embryon prenait sa forme mature et que l’hypophyse se formait. Conformément au dogme dominant, elle s’attendait à ce que le lobe frontal de l’hypophyse du poisson ne contienne que des cellules portant des étiquettes génétiques provenant de l’ectoderme oral de l’embryon au stade précoce, et le lobe postérieur, de l’ectoderme neural de l’embryon. Au lieu de cela, elle a découvert que certaines des cellules du lobe frontal descendaient de l’ectoderme neural de l’embryon.
« Cette découverte contredit l’idée que les deux parties de l’hypophyse ont des origines totalement distinctes », explique le Prof. Levkowitz. « Des recherches menées par d’autres scientifiques avaient laissé entendre que ces origines pouvaient être mixtes, mais avant notre étude, personne n’avait produit la preuve formelle.
La preuve définitive fournie par l’équipe du Prof. Levkowitz consistait en des cellules appartenant à un type spécifique qui s’allumaient dans le « mauvais » lobe de l’hypophyse. Les chercheurs ont pu les révéler en combinant les études de traçage génétique de Qiyu Chen dans l’embryon en développement avec la transcriptomique unicellulaire, une technique avancée qu’ils ont appliquée en collaboration avec le laboratoire du Prof. Ido Amit du Département d’Immunologie Systémique de Weizmann. Les scientifiques ont ainsi pu découvrir la composition moléculaire précise des cellules individuelles et suivre leur développement.
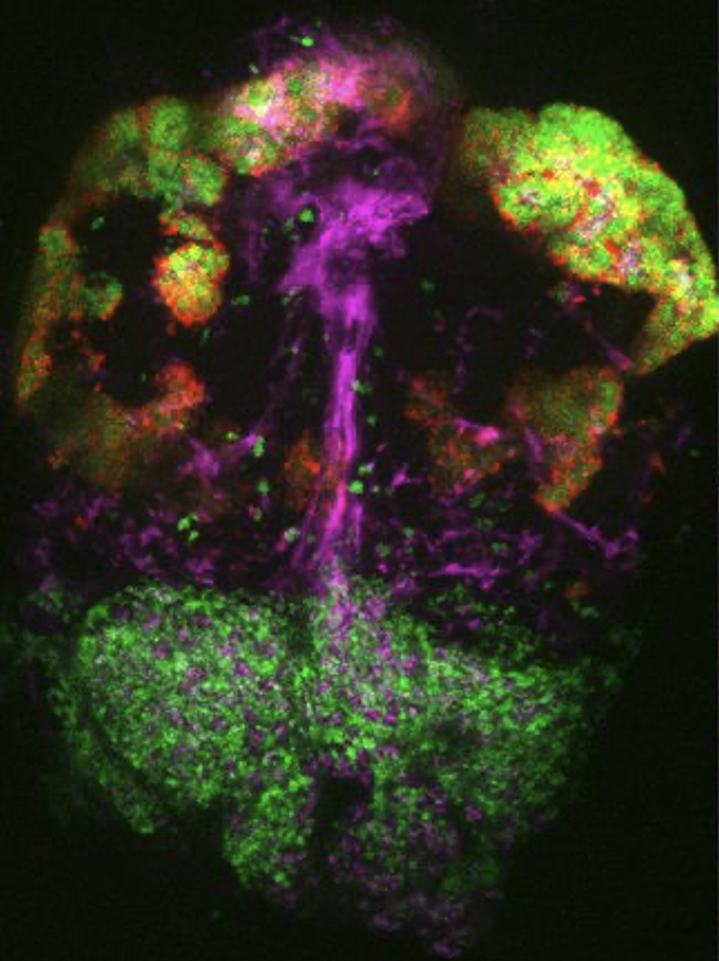
Image de l’hypophyse du poisson zèbre, révélant la diversité de ses populations cellulaires : les pituicytes astrogliales (violet) et deux types différents de cellules productrices d’hormones (rouge et vert).
Ils ont alors appris qu’une découverte similaire, non publiée, concernant l’origine mixte des cellules du lobe hypophysaire avait été faite sur des souris à l’Institut Francis Crick de Londres. La chercheuse principale de cette étude, le Dr Karine Rizzoti, marquait des cellules dans l’ectoderme neural d’embryons de souris. Lorsqu’elle a constaté par la suite que les descendants de certaines de ces cellules étaient détectés dans le lobe frontal de l’hypophyse de la souris, elle s’est d’abord montrée sceptique à l’égard de ses résultats. « Nous lui avons dit que nous avions fait des observations similaires avec des poissons », explique le Prof. Levkowitz, qui a invité le Dr. Rizzoti à collaborer avec son équipe sur ce projet. « Nous avons décidé d’unir nos forces pour présenter un dossier plus solide, avec deux espèces », explique-t-il.
En identifiant les signatures moléculaires exactes des principaux types de cellules de l’hypophyse, le projet a également abouti à une autre découverte : une diaphonie inconnue jusqu’alors entre différentes cellules appartenant aux parties frontale et postérieure de la glande. Les chercheurs ont découvert que certaines cellules du lobe postérieur, appelées pituicytes, influencent le développement des cellules productrices d’hormones dans le lobe frontal. Les pituicytes, un sous-type d’astroglies – cellules en forme d’étoile du système nerveux – étaient connues pour faciliter la libération des hormones ocytocine et vasopressine par le lobe postérieur de l’hypophyse. « Notre découverte a été une surprise : en plus de leur fonction déjà connue, les pituicytes jouent un rôle dans le développement de l’hypophyse frontale », explique Qiyu Chen.
« Nous en savons beaucoup sur l’anatomie de l’hypophyse, mais il reste encore beaucoup à apprendre sur sa composition génétique », déclare le Prof. Levkowitz. « Comprendre cette composition dans différentes cellules, comment elle apparaît au début du développement embryonnaire et comment les différents types de cellules s’influencent mutuellement, peut nous aider à comprendre ce qui ne va pas dans diverses maladies impliquant l’hypophyse. Il s’agit notamment du cancer et de certaines maladies infantiles, comme le déficit congénital en hormone de croissance. En fait, ce dernier déficit est dû à des mutations dans un gène qui affecte la décision des cellules ectodermiques embryonnaires précoces de devenir des cellules productrices d’hormones du lobe frontal de l’hypophyse ».
Le Prof. Levkowitz souligne que, pour l’essentiel, le dogme concernant les origines distinctes des deux lobes de l’hypophyse reste correct. « Cependant, notre découverte qu’une petite proportion des cellules productrices d’hormones du lobe frontal provient d’une partie du tissu embryonnaire différente de ce que l’on pensait auparavant, pourrait ouvrir de nouvelles voies pour explorer les dysfonctionnements de l’hypophyse ».
Qiyu Chen explique : « Par exemple, disons que vous avez 100 cellules d’hormone de croissance. Quatre-vingt-quinze d’entre elles proviennent de l’ectoderme oral, comme on le croyait généralement, mais il s’avère aujourd’hui, de manière surprenante, que cinq d’entre elles ont une origine neuronale. Les 100 cellules libèrent toutes la même hormone, mais peut-être le font-elles en réponse à des demandes physiologiques différentes. L’étude de la nature exacte de ces signaux pourrait à l’avenir permettre d’améliorer les méthodes de correction des déficits hormonaux, en ciblant des cellules hypophysaires spécifiques tout en évitant les effets indésirables sur les fonctions endocriniennes vitales de l’hypophyse ».
La Science en Chiffres
Le déficit hormonal hypophysaire combiné est une affection qui entraîne une insuffisance de deux hormones ou plus produites par l’hypophyse. Selon la Bibliothèque nationale de médecine des États-Unis, on estime qu’elle touche 1 personne sur 8 000 dans le monde.


