
06 Mar La touche humaine : concevoir des anticorps « humanisés » qui fonctionnent
Un nouvel algorithme pourrait accélérer considérablement le processus de création d’anticorps thérapeutique.
A la fin du XIXe siècle, les médecins ont commencé à traiter les maladies humaines avec du sérum sanguin extrait de chevaux immunisés. Mais ces extraits – qui contiennent des anticorps ciblant les agents pathogènes provoquaient souvent des réponses immunologiques désastreuses. À la fin du XXe siècle, les chercheurs ont relevé le défi en « humanisant » minutieusement les anticorps animaux afin d’éviter une réaction violente du système immunitaire du patient. Toutefois, le remplacement des segments animaux d’un anticorps par des segments humains est une opération laborieuse, longue et coûteuse, qui peut en outre rendre l’anticorps moins efficace, voire totalement inutile. Dans une étude publiée dans Nature Biomedical Engineering, des chercheurs de l’Institut Weizmann des Sciences ont mis au point un algorithme qui fonctionne selon un nouveau principe, offrant un moyen beaucoup plus rapide et moins coûteux d’adapter les anticorps animaux pour les rendre sûrs pour l’homme.
Les anticorps sont des protéines qui se déclinent en d’innombrables versions, chacune capable de neutraliser un agent pathogène spécifique après s’être liée à lui comme une clé dans une serrure. Ces protéines sont des molécules en forme de Y, dont la partie supérieure est constituée de deux « mains » tendues, orientées dans des directions opposées. Les mains sont dotées de « doigts » incroyablement variables, ce qui leur permet de reconnaître et de s’accrocher à un éventail pratiquement infini d’agents pathogènes, alors que la région de la tige du Y est relativement constante d’un anticorps à l’autre. Même si un anticorps animal possède souvent les bons « doigts » pour se lier à un pathogène humain, le reste de la molécule animale peut être identifié par le système immunitaire humain comme un envahisseur étranger qui doit être vaincu. C’est pourquoi l’injection d’anticorps animaux à des patients conduit souvent à des catastrophes.

(de gauche à droite) Ariel Tennenhouse, Lev Khmelnitsky, Prof. Sarel Fleishman et Razi Khalaila
« Humaniser un anticorps pour qu’il puisse combattre les maladies dans notre corps sans provoquer de réaction immunitaire peut s’avérer délicat », explique le chef d’équipe, le Prof. Sarel Fleishman, du Département des Sciences Biomoléculaires de Weizmann. Il explique que l’approche standard consiste à sélectionner un anticorps humain qui ressemble le plus à la version animale, puis à remplacer les segments animaux par des segments humains tout en conservant les éléments qui agissent contre la maladie. Mais comme les différentes parties de l’anticorps sont interconnectées, ces remplacements peuvent rendre l’anticorps instable et inefficace. « C’est comme si l’on modifiait les murs intérieurs d’une maison sans tenir compte de ses fondations », explique Ariel Tennenhouse, étudiant en maîtrise et auteur principal de l’étude.
La similitude en moins, la stabilité en plus
Le laboratoire du Prof. Fleishman a relevé le défi de trouver une meilleure approche. Le laboratoire est un centre de conception de protéines, dont les membres développent des programmes informatiques qui améliorent les protéines ou en génèrent de nouvelles. Comme on sait depuis des décennies que l’humanisation des anticorps animaux sur la base de leur similarité avec les anticorps humains aboutit souvent à des molécules instables, Ariel Tennenhouse a émis l’hypothèse que la stabilité pourrait être un critère plus fiable pour l’humanisation. Pour tester cette hypothèse, il a mis au point le CUMAb, un algorithme d’humanisation computationnelle des anticorps.
Avec ses collaborateurs, il a ensuite appliqué CUMAb pour explorer toutes les possibilités d’humanisation d’un anticorps de souris. L’algorithme a calculé un nombre impressionnant de 20 000 variantes humanisées d’un seul anticorps et a prédit la stabilité structurelle de chacune d’entre elles, sélectionnant les meilleures pour les tests.
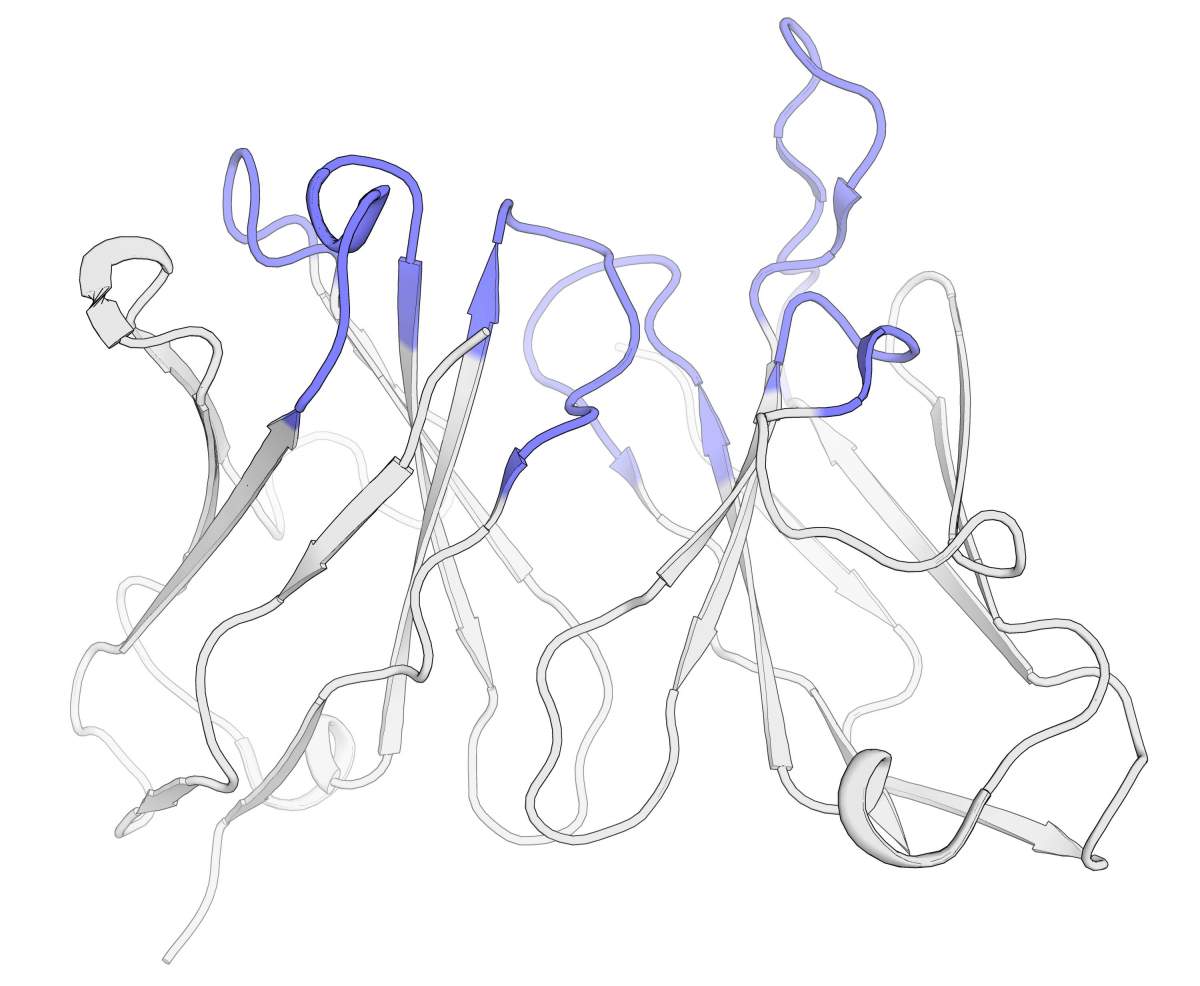
Structure 3D du « doigt » d’un anticorps, la partie qui se lie à une cible. Les régions colorées sont responsables de la reconnaissance de la cible ; les régions grises fournissent un soutien structurel. Le CUMAb remplace les régions grises par des fragments d’anticorps humains, ce qui permet de conserver, voire d’améliorer quelque peu l’interaction avec la cible, tout en stabilisant l’anticorps et en augmentant sa compatibilité avec le système immunitaire du patient.
L’étape suivante consistait à créer des versions « papier » des anticorps les mieux classés et à les tester pour vérifier si la CUMAb et l’hypothèse sur laquelle elle repose étaient correctes. L’équipe, en collaboration avec plusieurs autres laboratoires, a synthétisé cinq anticorps différents et les a testés expérimentalement. L’un de ces anticorps a été créé à partir d’une version murine d’un anticorps capable d’arrêter la croissance et la propagation des cellules cancéreuses. Les précédentes tentatives d’humanisation de cet anticorps étaient restées sans suite. Les scientifiques ont introduit la séquence de la version murine de cet anticorps dans le programme, choisissant les variantes les plus susceptibles de réussir pour les synthétiser et les tester.
« Les résultats ont été extraordinaires », déclare le Prof. Fleishman. « Sans aucun ajustement supplémentaire des modèles proposés, les anticorps humanisés ont fonctionné aussi efficacement que l’anticorps original de la souris. Les tests de quatre autres anticorps, tous conçus avec la CUMAb, ont été tout aussi impressionnants et ont même parfois dépassé l’activité ou la stabilité de l’anticorps animal d’origine.
La CUMAb est un nouvel outil puissant qui pourrait accélérer considérablement la conception de nouveaux médicaments à base d’anticorps et réduire les coûts de développement. Le Prof. Fleishman et son équipe ont transformé l’algorithme en un serveur web que tout universitaire peut utiliser. « C’est la première fois qu’une méthode s’avère aussi efficace pour résoudre ce problème critique d’ingénierie biomédicale. Il est fort probable qu’elle devienne un élément clé pour accélérer la transition entre les molécules thérapeutiques candidates et les médicaments du monde réel », déclare le Prof. Fleishman.
La nouvelle approche de l’humanisation des anticorps pourrait être appliquée à d’autres problèmes liés à l’ingénierie des anticorps thérapeutiques. Par exemple, de nombreuses formulations d’anticorps ont tendance à être très visqueuses et doivent être diluées avant d’être utilisées. Elles sont ensuite administrées par perfusion, et il faut parfois des heures pour faire passer une quantité suffisante d’anticorps dans le sang. Grâce à un programme informatique qui produit un certain nombre d’anticorps viables, les chercheurs pourraient être en mesure d’en choisir certains qui nécessitent moins de dilution ou qui présentent d’autres propriétés qui les rendent plus faciles ou plus agréables à administrer, ce qui améliorerait les résultats pour les patients.
« Nous espérons que CUMAb, désormais accessible en ligne, permettra aux chercheurs et aux professionnels de développer des anticorps plus rapidement et avec plus de précision », déclare Ariel Tennenhouse.
La Science en Chiffres
À ce jour, la Food and Drug Administration des États-Unis a approuvé l’utilisation de plus de 130 anticorps à des fins thérapeutiques. Environ 30 % des anticorps thérapeutiques sont d’origine murine et ont dû être humanisés.


