19 Oct Comment les mangeurs de cellules B nettoient leurs Assiettes
De mystérieux macrophages, qui digèrent rapidement les cellules B mourantes, pourraient fournir des indices sur les traitements futurs des maladies auto-immunes.
Les parents disent à leurs enfants de manger tout ce qu’il y a dans leur assiette, jusqu’à la dernière miette. Certaines cellules de nos ganglions lymphatiques, comme des enfants obéissants, suivent cette instruction avec diligence. Bien que ces cellules – un sous-type de macrophages, ou « gros mangeurs » – aient été décrites pour la première fois en 1884 par le biologiste allemand Walther Flemming, leur origine et leur mode de fonctionnement étaient jusqu’à présent restés un mystère. Dans une étude publiée dans le Journal of Experimental Medicine, une équipe de chercheurs dirigée par le professeur Ziv Shulman de l’Institut Weizmann des Sciences a fait des découvertes qui démystifient en grande partie les macrophages corporels tingibles (TBM). Ces cellules tingibles (c’est-à-dire colorables) mangent jusqu’au dernier morceau un autre type de cellules immunitaires, afin de protéger notre corps contre les agressions.
Les cellules destinées à l’assiette sont les cellules B productrices d’anticorps, qui résident dans les ganglions lymphatiques en prévision d’une invasion par des agents pathogènes tels que des virus ou des bactéries. En cas d’invasion, elles deviennent actives, se divisent rapidement et entrent dans des structures transitoires appelées centres germinaux. Ces centres, situés dans des niches spécifiques à l’intérieur des ganglions lymphatiques, sont des « camps d’entraînement » dans lesquels les cellules B affinent leurs défenses contre un ennemi particulier. Les cellules B subissent une sorte d’évolution accélérée, subissant des mutations aléatoires un million de fois plus rapidement que les cellules normales, un processus qui augmente la capacité de liaison des anticorps qu’elles produisent. Dans de rares cas, cependant, d’autres cellules B peuvent évoluer pour produire des auto-anticorps qui ciblent et endommagent les tissus sains de l’organisme au lieu des agents pathogènes.
 (de gauche à droite) Neta Gurwicz et le professeur Ziv Shulman
(de gauche à droite) Neta Gurwicz et le professeur Ziv Shulman
À la fin du « programme d’entraînement », les cellules qui ont subi des mutations bénéfiques survivent pour la plupart, tandis que celles qui portent des mutations inefficaces ou même nocives se « suicident » par un mécanisme de mort cellulaire programmée. Toutes ces cellules B mortes, bien qu’inactives, peuvent encore donner naissance à des anticorps nocifs. Comment empêcher cela ?
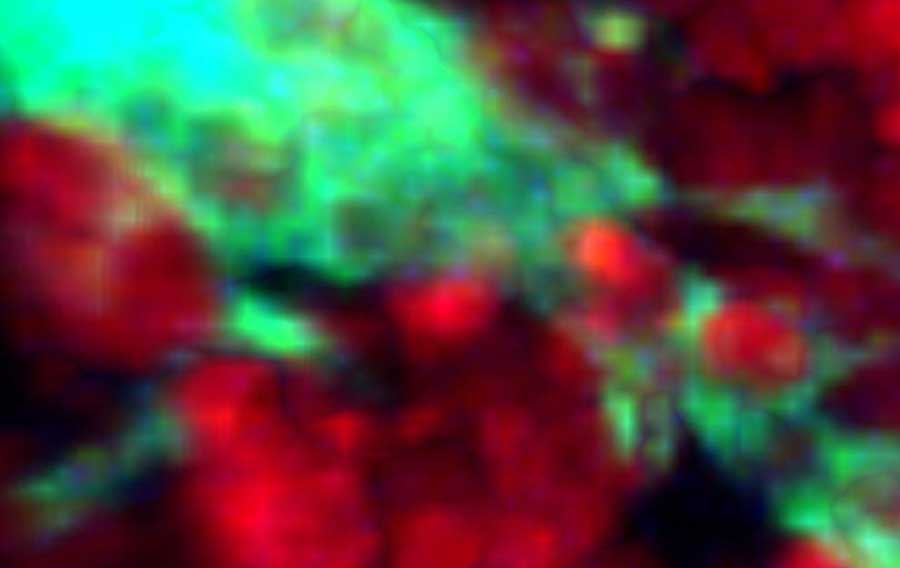
C’est là que les « gros mangeurs » entrent en jeu. Dans cette nouvelle étude, l’équipe, dirigée par Neta Gurwicz, étudiante en recherche au Département d’Immunologie Systémique de Weizmann, a utilisé des souris génétiquement modifiées pour découvrir les habitudes alimentaires et le régime des TBM. Les gènes de deux protéines fluorescentes différentes ont été utilisés pour marquer les « gros mangeurs » en vert brillant et les cellules B de leurs camps d’entraînement en rouge vif. Comme prévu, une semaine après que les souris ont été vaccinées de manière à activer les cellules B, des camps d’entraînement se sont ouverts dans les ganglions lymphatiques et les cellules B ont commencé à se multiplier, à muter et à subir une sélection. Grâce à la microchirurgie, les scientifiques ont exposé les ganglions lymphatiques des genoux des souris et y ont fixé un microscope perfectionné d’une résolution du micron (millionième de mètre) qui leur a permis d’observer les processus biologiques à l’intérieur d’un corps vivant.
Au cours de cette diffusion en temps réel, l’équipe a observé que les cellules B se déplaçaient constamment à l’intérieur du camp d’entraînement, tandis que les « gros mangeurs » restaient à proximité, tendant parfois des bras semblables à ceux d’une pieuvre pour attraper les cellules B mourantes et les engloutir. Les TBM le font à un rythme assez rapide : Chaque TBM a capturé une cellule B toutes les 10 minutes environ. À l’aide d’un modèle informatique, les scientifiques ont prédit qu’il faudrait environ 30 TBM pour nettoyer un seul camp d’entraînement de toutes ses cellules mourantes. Lors de la diffusion en direct, une moyenne de 25 TBM a été observée dans chaque camp, ce qui indique que le mécanisme de nettoyage est effectivement efficace et complet.
Recyclage des ganglions lymphatiques
Les chercheurs ont ensuite cherché à savoir si les TBM sont exigeants. Digèrent-ils toutes les cellules B qui passent ou préfèrent-ils grignoter celles qui se trouvent dans les camps d’entraînement ? L’équipe a découvert que lorsqu’ils étaient exposés à des cellules B inactives, les TBM n’avalaient pas l’appât et se concentraient uniquement sur les cellules B mutantes.
Une question demeure cependant : d’où viennent les TBM ?
Pour résoudre cette énigme, les scientifiques ont remplacé le système immunitaire des souris en les irradiant, puis en introduisant dans leur moelle osseuse des cellules sanguines progénitrices porteuses de gènes permettant de colorer en vert les futurs TBM. Lorsque les camps d’entraînement sont apparus dans les ganglions lymphatiques en réponse à la vaccination, 75 % des TBM avoisinants étaient verts, ce qui révèle que leur origine se trouve bien dans la moelle osseuse. Mais les cellules vertes ne sont apparues autour de ces camps d’entraînement que quelques semaines après la vaccination, ce qui soulève la possibilité que leur voyage ait comporté une escale.
L’équipe a répété l’expérience, cette fois en protégeant les ganglions lymphatiques pendant l’irradiation, de sorte que seules les cellules immunitaires présentes dans ces ganglions survivent, les autres étant éradiquées. Contrairement à l’expérience précédente, la plupart des cellules TBM qui se préparaient au festin n’étaient pas vertes ; elles se développaient à partir de cellules qui se trouvaient déjà dans les ganglions lymphatiques avant la vaccination. Les chercheurs ont conclu que les TBM se développent à partir de cellules progénitrices émergeant de la moelle osseuse, mais qu’au lieu de s’arrêter, elles se dirigent directement vers les ganglions lymphatiques et y attendent pendant un certain temps.
Les scientifiques ont également découvert ce qui pousse les cellules progénitrices à quitter la moelle osseuse et à entrer dans les ganglions lymphatiques. Cinq jours après la vaccination, lorsque de petites concentrations de cellules B mutantes sont apparues dans les camps d’entraînement, des quantités substantielles de TBM sont apparues à proximité. Les chercheurs en ont conclu que le moment de l’arrivée des TBM est fonction de l’entraînement des cellules B et que les TBM ont pour fonction particulière de faire le ménage après ce qui est une campagne très efficace, mais quelque peu inutile, du système immunitaire.
Enfin, les scientifiques ont demandé à quel moment, au cours du processus qui aboutit à leur suicide, les cellules B sont digérées par les TBM. De manière surprenante, ils ont observé que les cellules B étaient englouties vivantes, subissant leurs derniers soupirs à l’intérieur des TBM. Cela montre que les « gros mangeurs » ne sont pas seulement des « agents de nettoyage », comme on le pensait auparavant, mais qu’ils constituent également une « poubelle » biologique qui élimine les cellules mourantes avant qu’elles ne commencent à se décomposer, empêchant ainsi les déchets nocifs de se disperser en premier lieu.
« Un nettoyage défectueux par les TBM pourrait entraîner la production d’auto-anticorps qui viseraient les cellules B mortes mais qui, en fait, endommageraient les tissus sains », explique le professeur Shulman. « Cela pourrait être l’une des causes de maladies auto-immunes telles que le lupus. La compréhension fondamentale de l’origine des TBM et de leurs modes d’action pourrait ouvrir la voie à des traitements des maladies auto-immunes. Si nous trouvons comment rendre les TBM plus efficaces pour nettoyer les « camps d’entraînement », nous pourrions avoir la clé du traitement de maladies actuellement incurables ».
Les recherches du professeur Ziv Shulman sont soutenues par le Moross Integrated Cancer Center, la Rising Tide Foundation, la Azrieli Foundation, la Ben B. and Joyce E. Eisenberg Foundation, le Wolfson Family Charitable Trust & Wolfson Foundation, Elie Hirschfeld et le docteur Sarah Schlesinger, ainsi que Miel de Botton.


