16 Août Les médicaments d’immunothérapie appuient sur l’accélérateur
Il arrive que les anticorps anticancéreux appuient à la fois sur l’accélérateur et sur le frein. De nouvelles recherches pourraient les aider à mieux accélérer.
Sur la route, le fait d’appuyer sur la pédale d’accélérateur ou de frein permet de contrôler la vitesse de la voiture. Il en va de même dans notre corps, lorsqu’il s’agit de conduire une réponse immunitaire. Comme les conducteurs humains, les anticorps ont un « pied » – une sorte de membre moléculaire – qui « appuie » sur les pédales d’accélérateur et de frein. Ces pédales sont des récepteurs situés sur les membranes externes des cellules immunitaires : lorsqu’un pied d’anticorps se lie à l’une de ces pédales, il peut soit accélérer la réponse immunitaire, soit la ralentir. Parmi leurs autres utilisations, les anticorps sont employés dans une nouvelle génération de traitements anticancéreux connus sous le nom d’immunothérapie, qui exploitent les capacités naturelles du système immunitaire pour combattre les tumeurs malignes. En ce qui concerne ces anticorps anticancéreux, la rapidité est essentielle.
Une nouvelle étude, menée par une équipe de chercheurs dirigée par le Dr Rony Dahan de l’Institut Weizmann des Sciences, a révélé qu’une petite modification moléculaire dans un anticorps d’immunothérapie courant pourrait lui permettre de mieux se lier à certains récepteurs « à pédale d’accélérateur », accélérant ainsi la réponse immunitaire contre le cancer. L’étude, publiée dans Science Immunology, montre également que l’ajout d’un second anticorps – qui bloque les « pédales de frein » que sont les récepteurs inhibiteurs – peut améliorer l’efficacité des traitements anticancéreux.

(de gauche à droite) Dr. Rony Dahan et Noy Cohen Saban. L’immunothérapie à haute teneur en octane
En 2016, la Food and Drug Administration des États-Unis a approuvé un traitement d’immunothérapie révolutionnaire qui utilise des anticorps pour bloquer une protéine appelée PD-L1. Les cellules cancéreuses peuvent exploiter PD-L1 pour supprimer la réponse immunitaire contre elles en « épuisant » les cellules T qui combattent le cancer. Les anticorps actuellement utilisés ont été conçus pour agir de manière directe : Ils neutralisent PD-L1, l’empêchant ainsi de se lier aux cellules T et de les épuiser.
Dans une étude précédente, le Dr. Dahan a découvert que les anticorps anti-PD-L1 pouvaient également agir de manière indirecte, non seulement en neutralisant la protéine, mais aussi en se liant aux récepteurs des cellules immunitaires et en les activant contre les cellules cancéreuses exprimant PD-L1. Cette étude, qui suggérait que les anticorps renforçaient l’efficacité du traitement, avait été réalisée avec des anticorps de souris, et non avec la version humaine utilisée dans les traitements anticancéreux.
Dans leur nouvelle étude, le Dr. Dahan et son équipe du Département d’Immunologie Systémique de Weizmann ont vérifié si ces résultats étaient valables pour les médicaments destinés à l’homme. Pour ce faire, les scientifiques ont utilisé des souris dites humanisées, dans lesquelles le génie génétique a été utilisé pour remplacer les gènes des récepteurs d’anticorps de souris par des gènes humains. Après avoir induit des tumeurs chez ces souris, les scientifiques les ont traitées avec deux anticorps utilisés en clinique : l’un qui ne peut pas se lier aux récepteurs des cellules immunitaires (le médicament atezolizumab) et l’autre qui le peut (le médicament avelumab).
Dirigée par Miss Noy Cohen Saban, étudiante en recherche, l’équipe a suivi le taux de croissance des tumeurs dans les deux groupes de souris. Comme les scientifiques savaient que les anticorps de liaison activaient également les cellules immunitaires qui combattent le cancer, ils ont été surpris de découvrir qu’il n’y avait pas de différence significative entre les groupes. Pourquoi la version humaine du médicament n’a-t-elle pas donné les mêmes résultats que chez les souris ordinaires ?

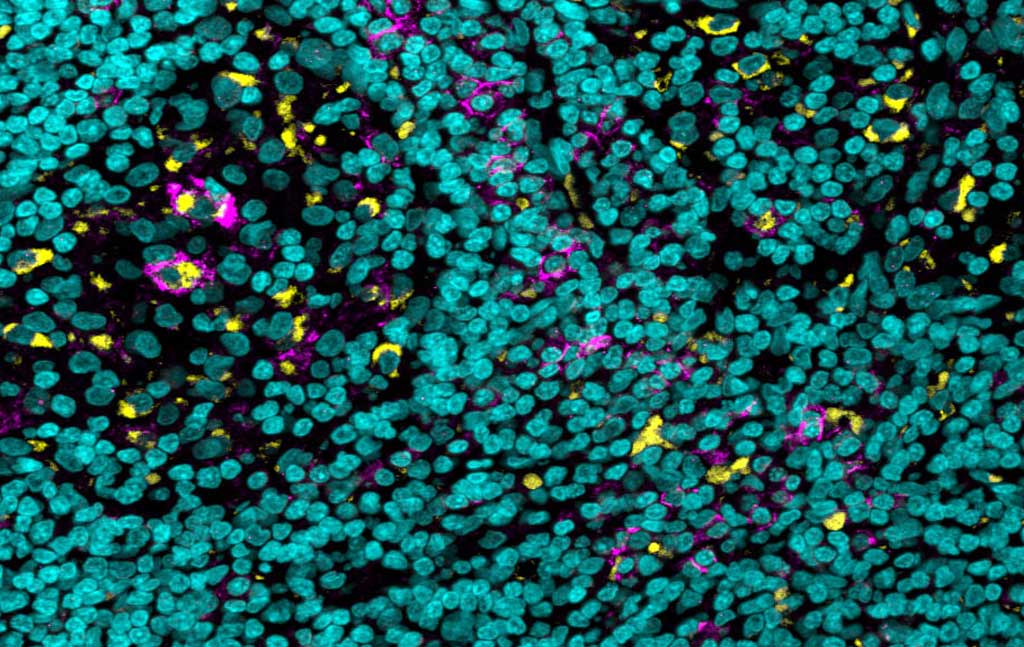
Un échantillon de tissu d’un cancer de la peau particulièrement agressif révèle des cellules immunitaires (en jaune) qui expriment à leur surface un récepteur de « pédale de frein » appelé FcgIIb (en violet) ; les noyaux cellulaires sont en bleu.
Les chercheurs savaient, grâce à des études antérieures, que si la liaison des anticorps à la plupart des récepteurs agit comme une pédale d’accélérateur qui renforce la réponse immunitaire, il existe un récepteur qui agit comme une pédale de frein et dont la liaison inhibe la réponse. Un examen plus approfondi a révélé que, par rapport aux cellules similaires d’autres organes, il y avait beaucoup plus de ces récepteurs à pédale de frein sur certaines cellules immunitaires dans le microenvironnement de la tumeur. Ce phénomène a également été observé dans les tumeurs humaines. Dans des échantillons de tumeurs de la peau et du rein, obtenus par l’intermédiaire de l’université du Michigan, les scientifiques ont identifié une expression accrue des récepteurs immunosuppresseurs.
Autrement dit, malgré la stimulation du système immunitaire par le médicament, l’effet total revenait à appuyer simultanément sur les pédales d’accélérateur et de frein. Une fois que les scientifiques ont compris ce qui se passait, ils ont retenté l’expérience, en administrant cette fois aux souris un traitement combiné d’avelumab et d’un second anticorps dont il a été prouvé qu’il inhibait les récepteurs immunosuppresseurs. Une fois le pied levé sur les freins du système immunitaire, le traitement du cancer s’est avéré beaucoup plus efficace.
Les chercheurs ont pensé qu’ils pourraient rendre les anticorps encore plus efficaces en appuyant plus fort sur les « pédales d’accélérateur », c’est-à-dire qu’ils ont cherché un moyen de faire en sorte que les « pieds » des anticorps se lient plus étroitement aux récepteurs qui renforcent le système immunitaire. Ils ont créé une petite modification dans une molécule de sucre associée au pied de l’anticorps – une modification qui peut multiplier par onze l’affinité de liaison de l’anticorps modifié, c’est à dire renforcer onze fois la fixation de l’anticorps sur son récepteur. Et en effet, après le traitement avec les nouveaux anticorps améliorés, la taille des tumeurs chez les souris humanisées était plus petite, et la durée de survie moyenne des souris traitées était plus longue.

Science Immunology a présenté les recherches du Dr Rony Dahan en couverture du numéro de mars 2023 de la revue.
Enfin, l’équipe s’est penchée sur le mécanisme d’action à l’origine du succès de leur anticorps amélioré. Ils ont découvert que cet anticorps conférait au traitement anticancéreux un double avantage : il était capable à la fois d’augmenter le nombre de cellules T – les cellules immunitaires responsables de la destruction des cellules cancéreuses – pénétrant dans la tumeur et de diminuer le nombre de certaines cellules myéloïdes – des cellules immunitaires qui inhibent la réponse anticancéreuse dans le microenvironnement de la tumeur.
« Les résultats de cette recherche pourraient passer rapidement du laboratoire à la clinique, afin d’améliorer les médicaments déjà disponibles pour les patients atteints de cancer », explique le Dr Dahan. « En outre, la découverte d’anticorps améliorés qui agissent sur des cellules immunitaires autres que les cellules T offre la possibilité de les utiliser dans le traitement de certains cancers encore incurables pour lesquels les thérapies aidant les cellules T sont inefficaces. »
La science en chiffres
A ce jour, la FDA a approuvé 96 immunothérapies basées sur 7 anticorps anti-PD-L1/PD-1 pour le traitement de 24 indications cancéreuses distinctes.


