09 Mai Des voyous dans le voisinage cellulaire
Des scientifiques de l’Institut Weizmann ont découvert comment les mutations des gènes BRCA, particulièrement répandues chez les juifs ashkénazes, entraînent le recrutement d' »assistants » cellulaires dans le cancer du pancréas.
L’intimidation, malheureusement, peut être contagieuse. Cela vaut non seulement à l’école ou dans la cour de récréation, mais aussi dans le voisinage cellulaire. C’est pourquoi, dans une nouvelle étude, une équipe de chercheurs dirigée par le Dr Ruth Scherz-Shouval, de l’Institut Weizmann des Sciences, s’est intéressée non seulement au comportement « tyrannique » des cellules cancéreuses, mais aussi à ses effets délétères sur les cellules du microenvironnement autour de la tumeur. Ces cellules non malignes peuvent aider l’organisme à lutter contre le cancer, mais il arrive qu’elles sapent cette lutte en devenant des collaboratrices des cellules cancéreuses. Dans cette étude, les scientifiques révèlent comment les mutations des gènes BRCA, bien connus pour leur rôle dans le cancer du sein et de l’ovaire, ont un effet négatif sur un sous-ensemble important de cellules du microenvironnement du cancer du pancréas, altérant la réponse immunitaire anticancéreuse de l’organisme. Les gènes BRCA, dans leur forme normale, jouent un rôle important dans les mécanismes cellulaires qui réparent l’ADN endommagé, mais certaines personnes naissent avec un gène BRCA contenant de petits changements (mutations) qui perturbent sa fonction. Bien que ces mutations – particulièrement fréquentes chez les juifs ashkénazes – concernent surtout des femmes qui subissent un dépistage préventif du cancer du sein et de l’ovaire, il a été démontré qu’elles augmentent le risque de cancer chez les hommes également, notamment de tumeurs du pancréas et de la prostate. Pourtant, la sensibilisation à ce risque et le taux de dépistage des mutations BRCA restent faibles chez les hommes.

(g-d) Coral Halperin, Dr. Ruth Scherz-Shouval et Aviad Ben-Shmuel
Les chercheurs ont mené cette nouvelle étude sur l’adénocarcinome du canal pancréatique, un type de cancer du pancréas commun et particulièrement agressif qui reste largement incurable. Seuls 10 % des personnes diagnostiquées survivent plus de cinq ans après le diagnostic. Des études antérieures avaient montré que dans cette tumeur maligne, les cellules cancéreuses parviennent à recâbler et même à modifier la structure et la fonction de certaines cellules, appelées fibroblastes, dans leur microenvironnement. Les fibroblastes, qui forment l’échafaudage maintenant les cellules en place, sont des composants de base de chaque organe de notre corps. Dans le cas du cancer du pancréas, ils peuvent représenter jusqu’à 90 % du tissu tumoral. Une fois que ces cellules passent du côté du cancer, elles sont reprogrammées en différentes sous-populations de fibroblastes associées au cancer. Toutefois, on ignore encore largement si différentes mutations liées au cancer, telles que celles des gènes BRCA, entraînent différents types de reprogrammation des fibroblastes.
Pour tenter de trouver la réponse, les chercheurs – dirigés par les docteurs Lee Shaashua, Aviad Ben-Shmuel et Meirav Pevsner-Fischer du groupe du dr. Scherz-Shouval au Département des Sciences Biomoléculaires de Weizmann – ont cherché à établir si les mutations BRCA produisent un effet négatif unique sur les fibroblastes dans le microenvironnement tumoral du cancer du pancréas. En collaboration avec le Memorial Sloan Kettering Cancer Center de New York, ils ont utilisé des méthodes de recherche innovantes pour cartographier et comparer les fibroblastes dans des échantillons de tumeurs pancréatiques prélevés sur des patients avec et sans mutations BRCA.
Les scientifiques ont constaté que ces deux types de tumeurs présentaient des différences significatives dans la composition de leurs sous-populations de fibroblastes. Ils ont notamment découvert que les tumeurs pancréatiques présentant des mutations BRCA contiennent une sous-population relativement importante de certains fibroblastes – ceux qui contiennent la protéine clusterine. Cette protéine chaperon, qui aide d’autres protéines cellulaires à fonctionner correctement, avait été trouvée dans des études antérieures comme contribuant au développement des tumeurs du cancer du pancréas.
Ensuite, à l’aide de cultures cellulaires et de modèles murins de cancer, les chercheurs ont réduit au silence un gène BRCA dans des cellules cancéreuses, de manière à imiter la perte de sa fonction induite par la mutation. Ces expériences ont révélé comment les mutations BRCA déclenchent un changement dans la composition des fibroblastes adjacents, même si les fibroblastes ne sont pas eux-mêmes porteurs de la mutation. Il s’est avéré que le coupable, responsable de la proportion accrue de fibroblastes exprimant la clusterine, est la protéine HSF1. Dans les cellules saines, cette protéine est activée en réponse au stress ; dans des études antérieures, y compris celles menées dans le laboratoire du Dr. Scherz-Shouval, on avait découvert qu’elle jouait un rôle dans la transformation des fibroblastes en cellules cancéreuses.
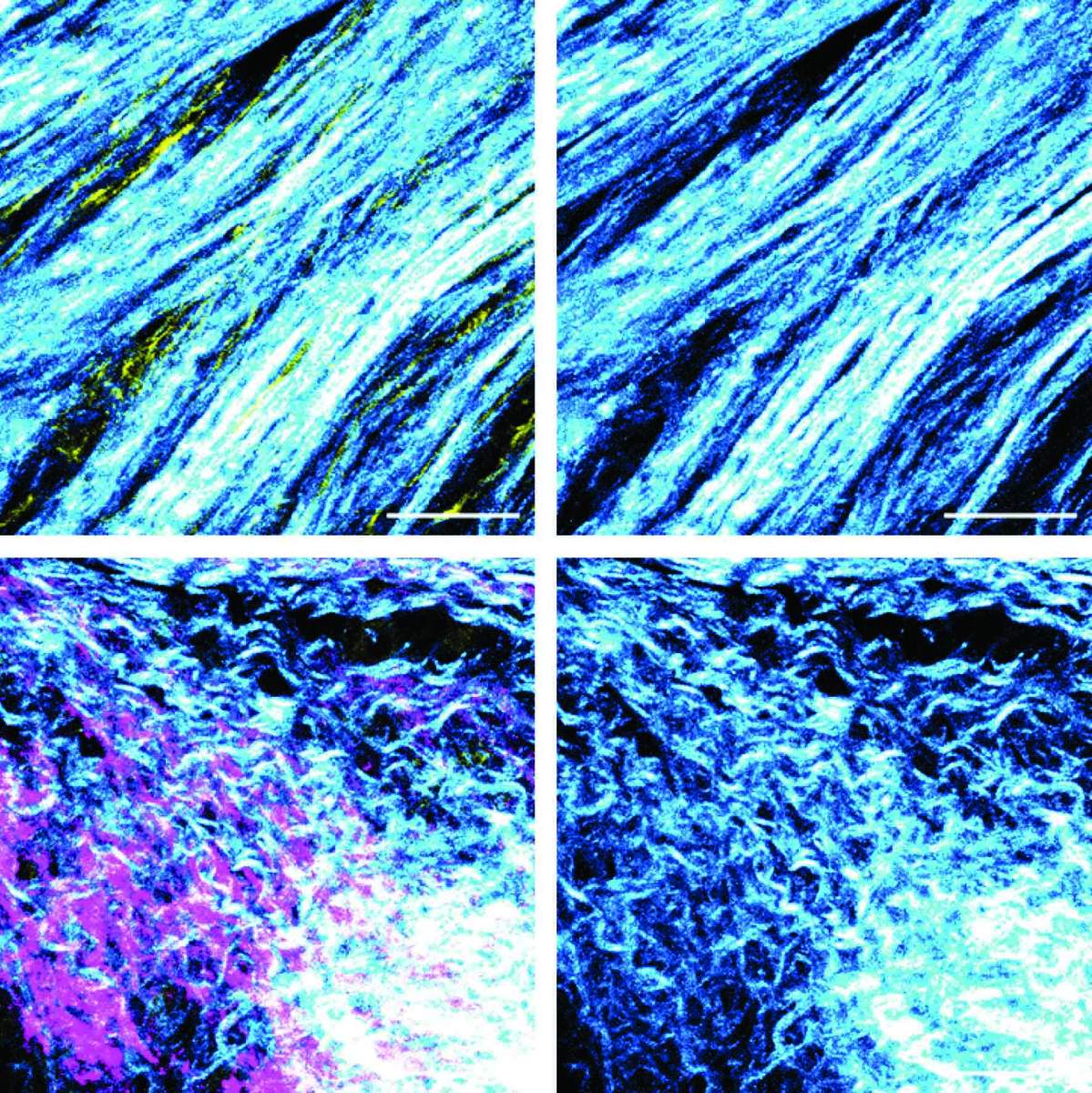
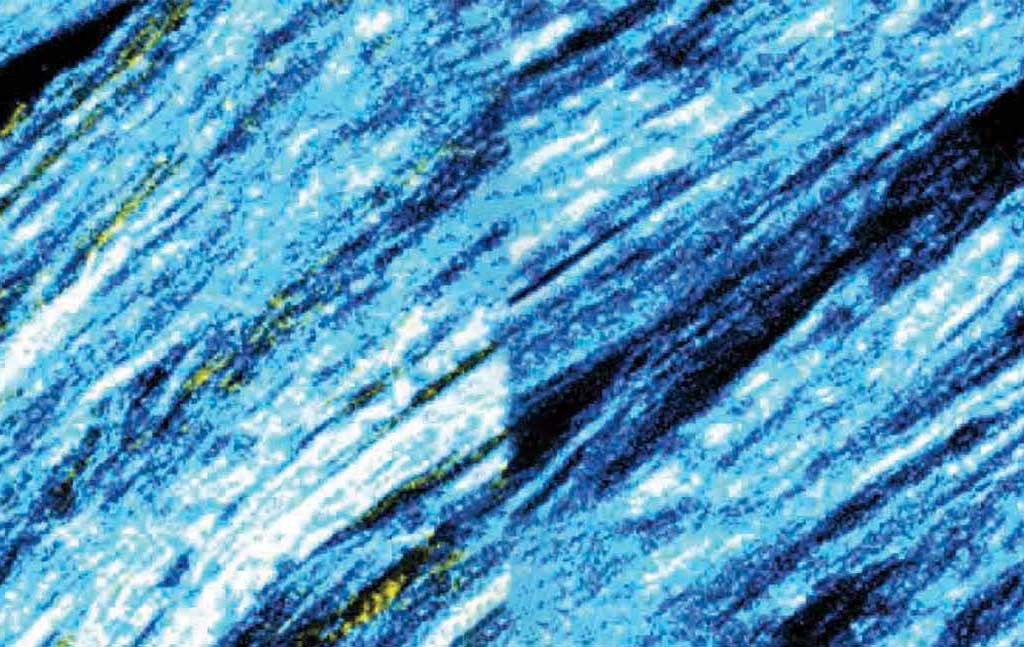
Fibres de collagène déposées par les fibroblastes dans le microenvironnement tumoral, vues au microscope. Les fibres forment un motif ordonné dans les tumeurs dont le gène BRCA n’est pas muté (en haut) ; en revanche, dans les tumeurs de patients porteurs de mutations BRCA (en bas), la structure du collagène est désordonnée.
Au cours d’autres expériences, les chercheurs ont découvert que l’inhibition du BRCA dans les cellules cancéreuses entraînait une modification de la fonction des fibroblastes adjacents, qui commençaient alors à supprimer les lymphocytes T du système immunitaire. Les chercheurs ont également identifié un changement structural dans les fibres produites par les fibroblastes : Dans les tumeurs avec un gène BRCA actif et non muté, les fibroblastes génèrent des fibres dures formant un maillage dense, tandis que dans les tumeurs sans activité BRCA, les fibroblastes produisent des fibres ramifiées et plus souples.
Ces résultats suggèrent que dans les tumeurs pancréatiques portant des mutations BRCA, l’action des fibroblastes en tant que producteurs de fibres pour l’environnement intercellulaire est considérablement réduite. Au lieu de cela, ils agissent comme des suppresseurs de la réponse immunitaire, contribuant ainsi au développement des tumeurs malignes.
Ouvrir la voie à de nouvelles thérapies
Toutes les cellules de notre corps fonctionnent avec la même information génétique, mais cette information est exprimée de manière totalement différente dans les différents types de cellules, tissus et organes. Les différences entre les diverses cellules du corps sont dues à des changements et des ajouts de modifications à l’ADN. Ces modifications fonctionnent comme des signes de ponctuation permettant à la cellule de lire correctement le code et de produire des protéines en conséquence. Ces signes déterminent, par exemple, s’il faut augmenter la production d’une certaine protéine (ce qui est peut-être similaire au rôle d’un point d’exclamation) ou même s’il faut lire ou pas un certain gène. Ces modifications et ajouts à l’ADN sont étudiés de près dans un domaine appelé épigénétique (du grec « au-dessus de la génétique »).
Dans une autre étude du laboratoire du Dr. Scherz-Shouval, les scientifiques se sont intéressés à un autre aspect de la conversion des fibroblastes en « brutes » : les mécanismes épigénétiques employés par les cellules cancéreuses pour le recâblage des fibroblastes. Dans cette étude, dirigée par Coral Halperin du laboratoire du Dr. Scherz-Shouval, en collaboration avec le Dr Joschka Hey du laboratoire du professeur Christoph Plass au Centre Allemand de Recherche sur le Cancer (DKFZ), l’équipe a montré, dans des modèles murins de cancer du sein, que les cellules cancéreuses induisent des altérations épigénétiques dans les fibroblastes normaux. En conséquence, contrairement à ce qui se passe dans les tissus sains, ces fibroblastes modifient l’expression de certains gènes et produisent des protéines favorisant le cancer. Les chercheurs ont également établi une corrélation entre ces modifications et une élévation des niveaux d’une protéine appelée RUNX1 : Sa production a également augmenté dans les fibroblastes des patients cancéreux, et son activation pourrait être responsable des altérations épigénétiques.
« Le traitement du cancer a été révolutionné ces dernières années par l’introduction de l’immunothérapie – des médicaments qui recrutent le système immunitaire dans une attaque ciblée sur les cellules cancéreuses », déclare le Dr. Scherz-Shouval. « Il est à espérer que les connaissances que nous et d’autres chercheurs avons rassemblées – y compris l’identification des sous-types de fibroblastes supprimant la réponse immunitaire et des protéines impliquées dans la transformation des fibroblastes en promoteurs du cancer – pourront être exploitées pour développer de nouveaux médicaments. De tels médicaments, associés à des traitements immunothérapeutiques, permettraient de cibler efficacement non seulement les cellules cancéreuses, mais aussi leurs collaborateurs. »
La Science en chiffres
Une personne sur 400 dans la population générale – et 1 juif ashkénaze sur 40 – est née avec des mutations dans les gènes BRCA qui augmentent le risque de plusieurs types de cancer.


