02 Fév Chaperon glissant : Le mucus intestinal se charge du cuivre
Des chercheurs de l’Institut Weizmann ont montré que les protéines de notre « mucus intelligent » absorbent les ions potentiellement toxiques et les acheminent en toute sécurité vers les cellules.
Le mucus du corps humain est bien plus qu’une simple substance visqueuse. Couvrant de vastes zones, un type de cette matière intelligente protège nos poumons en filtrant les micro-organismes dangereux tout en permettant l’échange de gaz. Dans la paroi interne de nos intestins, un autre type de mucus, qui couvre également une grande partie du corps – la taille d’un court de tennis dans l’intestin d’un adulte – empêche les matières indésirables d’entrer dans nos organes internes tout en laissant passer les nutriments et les fluides dont nous avons besoin.
Dans une étude récente, des chercheurs de l’Institut Weizmann des Sciences ont découvert que le mucus intestinal remplit une autre fonction cruciale mais inattendue : Il peut attraper, convertir et apporter en toute sécurité dans nos cellules un matériau potentiellement toxique mais nécessaire – le cuivre.

Prof. Deborah Fass (g) et Nava Reznik (d)
L’équipe du laboratoire du professeur Deborah Fass, au Département de Biologie Chimique et Structurale de Weizmann, s’est engagée sur la voie qui a mené à cette découverte en cartographiant la structure d’une protéine appelée mucine, un composant majeur du mucus. Cette cartographie constituait un formidable défi, compte tenu de la taille gigantesque des molécules de mucine, qui s’assemblent pour former des réseaux encore plus grands, permettant au mucus de remplir ses diverses fonctions. Après avoir réussi à déterminer la structure d’un gros fragment de la molécule de mucine, les scientifiques ont observé quelque chose qui semblait à la fois familier et déplacé : un ensemble d’acides aminés qui ressemblait beaucoup à un site de liaison pour un métal.
C’était une découverte intrigante car elle suggérait des rôles métaboliques du mucus inconnus jusqu’alors. Les scientifiques ont ajouté à de la mucine des ions de différents métaux pour voir si certains d’entre eux allaient s’y accrocher. Ils ont fini par conclure que les sites étaient destinés à retenir le cuivre.
Présent dans les crustacés, les poissons, les noix, les graines et le chocolat noir, le cuivre est moins connu pour sa valeur nutritionnelle que certains autres oligo-éléments, comme le zinc et le fer, mais il est tout aussi important pour notre organisme. Associé à diverses enzymes, il permet à nos cellules de produire de l’énergie, contribue à la formation du tissu conjonctif, facilite la croissance de nouveaux vaisseaux sanguins et bien plus encore.
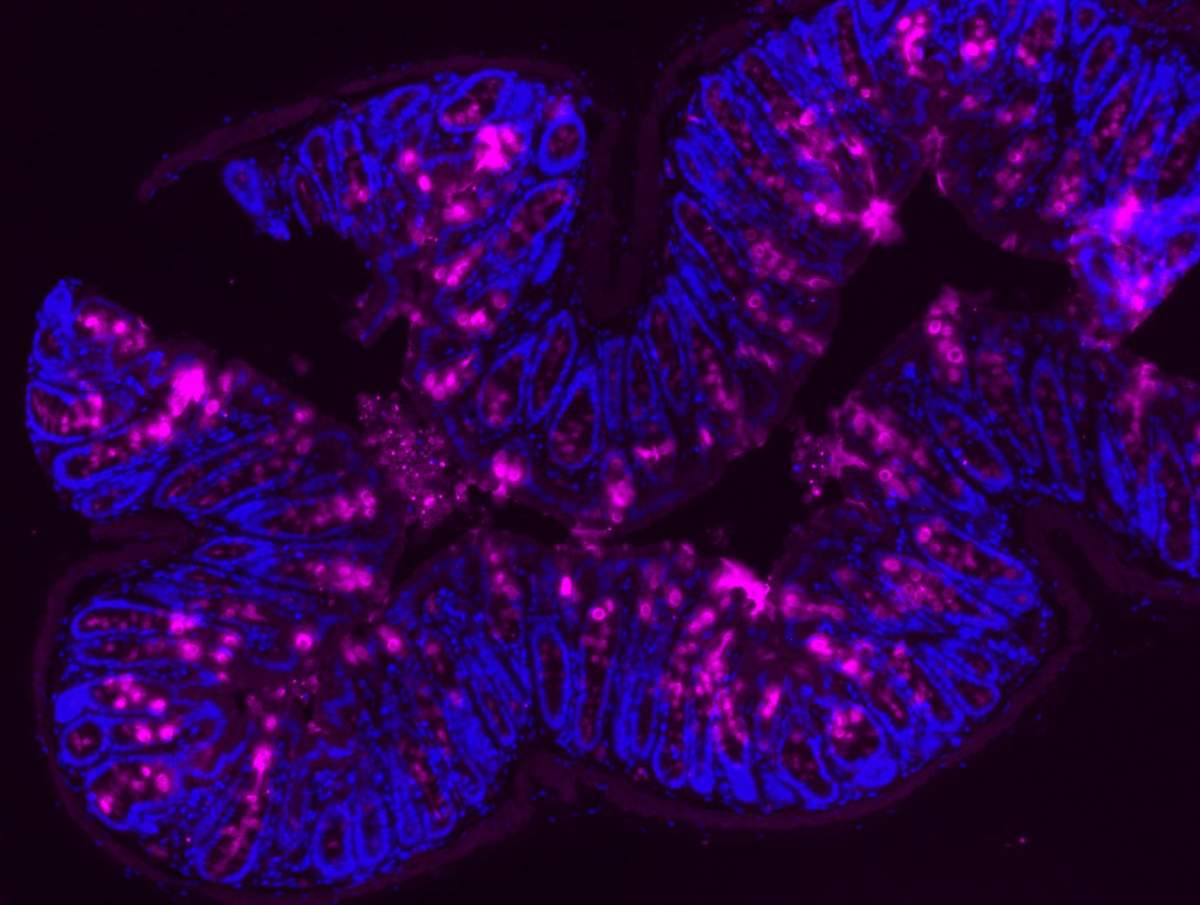
Mucine (magenta) dans la paroi interne du côlon d’une souris, vue au microscope.
Mais le cuivre peut aussi être dangereux. Les ions cuivre sont capables de stocker et de transporter les électrons nécessaires aux réactions biochimiques. Or, cette même capacité leur permet de transmettre des électrons à l’oxygène, générant ainsi des molécules d’oxygène réactif qui peuvent endommager les cellules.
« Le jeu auquel l’organisme doit se livrer consiste à déplacer le cuivre de l’alimentation vers les endroits où il est nécessaire, sans le laisser faire des dégâts en cours de route », explique le Prof. Fass. Son équipe a réalisé une série d’expériences élégantes pour voir si le mucus aide le corps à faire cela.
Nava Reznik, qui a mené cette étude dans le laboratoire du Prof. Fass, a cristallisé une partie de la molécule de mucine intestinale avec du cuivre. Elle a découvert que cette mucine possédait deux sites de liaison : l’un pour les ions de cuivre à double charge positive, qui est la forme que notre corps ingère dans les aliments, et l’autre pour les ions de cuivre à simple charge positive, la forme qui pénètre dans les cellules et dont l’électron supplémentaire a le potentiel de faire du bien ou du mal.
Les chercheurs ont émis l’hypothèse que la mucine intestinale aide les ions cuivre à charge double positive à capter un électron, les transformant ainsi en ions à charge unique. La mucine maintient ensuite ces ions à charge unique en place, les empêchant de libérer les électrons nouvellement acquis au mauvais endroit. « La mucine ne permet pas au cuivre de s’échapper et d’endommager les choses », explique N. Reznik.
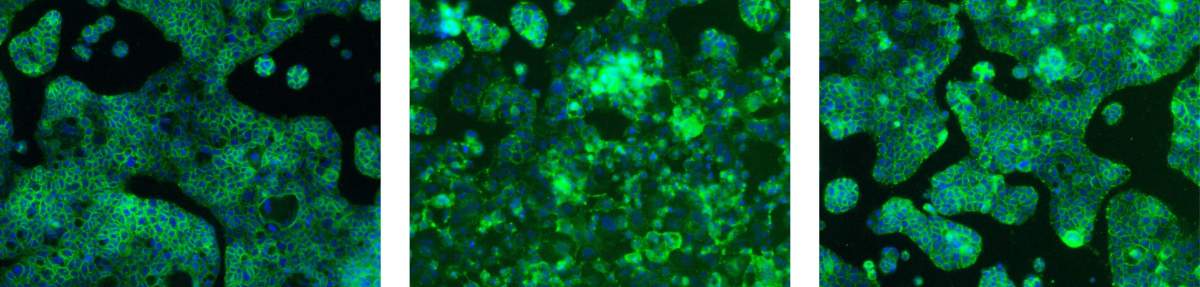
Une couche de cellules saines (à gauche) a commencé à se dégrader lorsqu’elle a été exposée au cuivre (au milieu), mais est restée intacte lorsque le cuivre a été ajouté à la mucine (à droite).
Lors d’expériences visant à vérifier cette hypothèse, l’équipe a montré que la mucine intestinale stoppe la dégradation des cellules causée par l’exposition au cuivre, mais qu’elle permet tout de même aux cellules privées de cuivre d’absorber des ions cuivre en toute sécurité et de se rétablir. Les chercheurs ont mené leurs expériences sur des cellules en culture, mais ils pensent que les processus qu’ils ont mis en évidence sont les mêmes que ceux qui se déroulent dans l’organisme, explique N. Reznik.
Les résultats de l’étude suggèrent que la mucine intestinale est un chaperon, une sorte de protéine d’assistance, pour le cuivre. Grâce à ses deux sites de liaison au cuivre, la mucine assure le bon comportement de ce métal parfois perturbateur. Les chercheurs pensent que la mucine chaperon pourrait également être impliquée dans l’acheminement du cuivre aux microbes de notre intestin, qui ont également besoin de cet oligoélément.
« On sait depuis des décennies que le cuivre est chaperonné par des protéines à l’intérieur des cellules, mais personne n’a pensé à se demander ce qui arrive au cuivre lorsqu’on l’ingère pour la première fois », explique le Prof. Fass.
L’étude suggère que la mucine intestinale pourrait également empêcher le gaspillage des antioxydants – des molécules bénéfiques qui ont des électrons à revendre – en empêchant les électrons de circuler continuellement des antioxydants au cuivre puis à l’oxygène. En retenant les ions cuivre à charge unique, la mucine semble empêcher ce cycle.
Prof. Fass : « Par exemple, que se passe-t-il si vous mangez un repas riche en cuivre et buvez du jus d’orange, qui contient de la vitamine C, un antioxydant ? Comment empêcher le flux d’électrons de la vitamine C et la génération d’oxygène réactif qui en résulte ? Apparemment, en retenant les ions cuivre à charge unique sur des sites de liaison dédiés, la mucine intestinale bloque ce flux. »
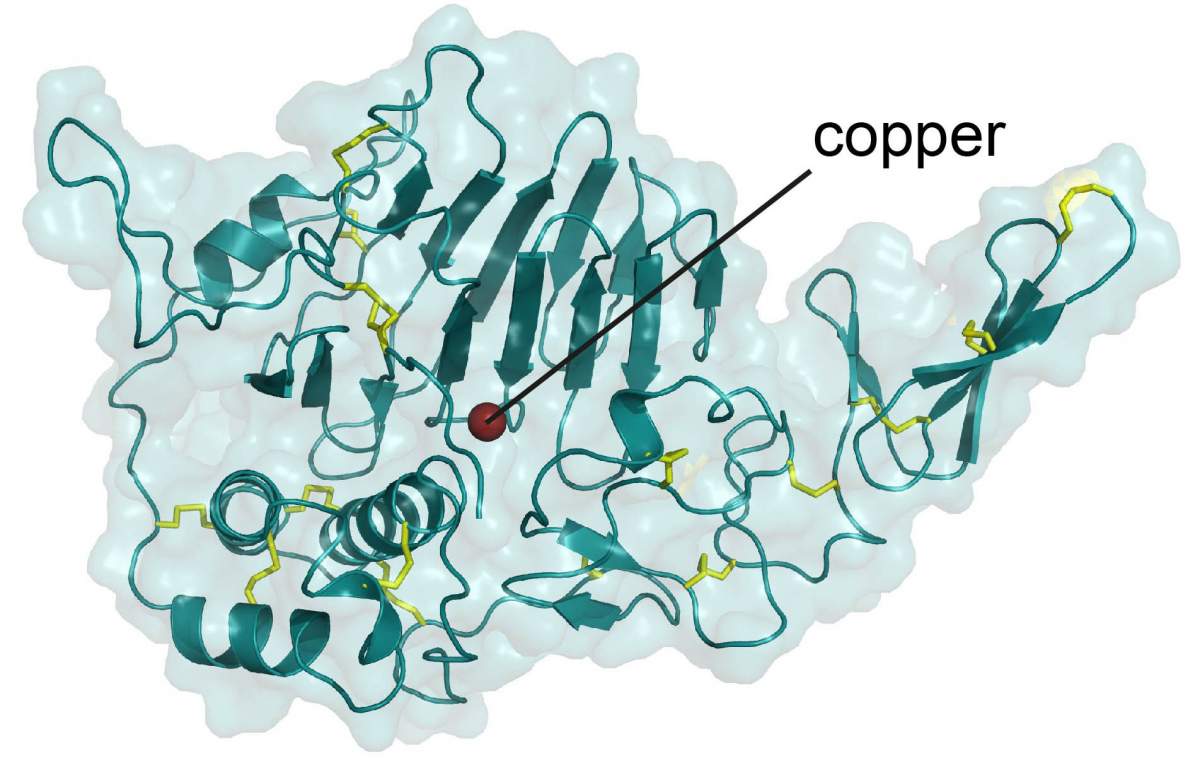
Diagramme structurel montrant la région d’une molécule de mucine qui contient un ion de cuivre (rouge).
Cette explication est indirectement étayée par le fait que, dans la mucine pulmonaire, l’équipe a observé un site de liaison pour une seule forme de cuivre – celle des ions cuivre à double charge positive. « Nous ne respirons pas de vitamine C. Sans cette source d’électrons, les ions cuivre à double charge ne sont pas convertis en ions à simple charge, et la mucine pulmonaire n’a pas besoin de les contrôler », explique Fass.
À l’heure où l’on découvre de nouveaux faits sur le mucus qui tapisse nos organes internes, la dernière découverte de l’équipe du Prof. Fass pourrait servir de base à d’autres études portant sur les mécanismes liés au mucus, notamment chez les personnes souffrant de carences en métaux potentiellement mortelles. « Si nous en apprenons davantage sur la façon dont le cuivre traverse la muqueuse et est absorbé par les cellules, nous pourrions peut-être mettre au point de meilleurs moyens de diriger les molécules de cuivre vers les tissus afin d’aider ces patients », explique le Prof. Fass.
Une nouvelle perspective s’est ouverte au Prof. Fass et à N.Reznik lors d’une récente conférence scientifique sur le métabolisme du cuivre, où ils ont présenté leur étude. Parmi les participants se trouvait un jeune garçon gravement handicapé par une carence en cuivre, accompagné d’un chercheur qui étudie les mécanismes moléculaires de son état. « La conférence a montré à quel point les questions relatives au métabolisme du cuivre sont réelles, non seulement en physiologie humaine en général, mais aussi en santé publique », déclare le Prof. Fass.
La déficience héréditaire en cuivre, également connue sous le nom de syndrome de Menkes, survient dans environ 1 cas sur 100 000 à 250 000 naissances vivantes. Elle ne touche que les hommes, qui héritent d’un gène mutant lié au chromosome X. La plupart des enfants nés avec cette déficience ne vivent pas au-delà de l’âge de 10 ans. Une autre maladie, la maladie de Wilson, qui est causée par un dépôt accru de cuivre dans le foie, le cerveau et la cornée, survient dans environ 1 cas sur 40 000 naissances. La maladie de Wilson est potentiellement mortelle, mais avec un traitement, les patients peuvent avoir une durée de vie normale.


