
17 Nov L’origine de la vie : dans la poche d’un ARN
Comment les acides aminés ont-ils commencé à se lier entre eux pour former des protéines ? Des chercheurs de l’Institut Weizmann des Sciences donnent vie à leurs découvertes dans leur laboratoire.
Cette histoire commence il y a plusieurs milliards d’années. Il n’y a que de la chimie, pas de biologie – c’est-à-dire qu’il existe de nombreux composés chimiques sur Terre, mais la vie n’est pas encore apparue. Puis, parmi des myriades de structures chimiques auto-assemblées de manière aléatoire, une minuscule machine moléculaire en ARN se révèle parfaitement apte à créer des liaisons entre des acides aminés activés, les éléments constitutifs des futures protéines. C’est un tournant dans l’histoire de notre planète : la synthèse des protéines, molécules biologiques essentielles à la vie, peut maintenant commencer. Le professeur Ada Yonath et son équipe de l’Institut Weizmann des Sciences pensent avoir recréé ce moment en laboratoire, montrant comment cela a pu se produire. Quant à la machine primordiale à fabriquer des liaisons peptidiques, ils ont découvert qu’elle est encore présente dans pratiquement toutes les cellules de tous les organismes vivants, des bactéries aux plantes et aux animaux, y compris nous-mêmes.
La théorie qui sous-tend le projet de l’équipe est née il y a une vingtaine d’années, à la suite de découvertes étonnantes faites dans le laboratoire le professeur Yonath lors de la détermination de la structure et de la fonction du ribosome – des recherches qui lui ont valu le prix Nobel de chimie 2009. Le ribosome exécute l’un des processus fondamentaux de la vie : la fabrication de protéines à partir des informations contenues dans l’ADN. « Nous avons découvert une caractéristique surprenante dans la structure de cette machine à fabriquer des protéines », explique le Dr Anat Bashan, chercheur principal dans le laboratoire du Prof. Yonath au sein du Département de Biologie Chimique et Structurelle de Weizmann. « Le ribosome est une énorme macromolécule qui n’est pas du tout symétrique ; en son cœur, il contient deux éléments semi-symétriques réunis pour former une poche. »

De gauche à droite : Dr. Anat Bashan et Dr.Tanaya Bose. Recréer des liens anciens
Le Prof. Yonath ajoute : « Nous avons été particulièrement frappés par le fait que cette poche se trouve dans les ribosomes de tous les organismes. Et c’est là que se déroule toute l’action – c’est là que se forment toutes les liaisons peptidiques qui créent la chaîne d’acides aminés liés entre eux qui composent une protéine. C’est pourquoi cette machinerie de base semble être restée inchangée au cours de l’évolution. »
Voici le protoribosome : C’est ainsi que les scientifiques appellent cette structure en forme de poche. Ils ont émis l’hypothèse que le protoribosome est l’ancêtre de tous les ribosomes modernes, une ancienne machine datant de la période précédant la vie. Par rapport à la taille de la cellule, le protoribosome est plutôt petit. Il est constitué de molécules d’ARN comprenant quelque 120 nucléotides, environ 60 pour chacun de ses deux composants semi-symétriques, ce qui représente moins de 5 % des dimensions du ribosome moderne : quelque 4 500 nucléotides chez la bactérie et près de 6 000 chez l’homme…
Voici comment le scénario s’est déroulé, selon le Prof. Yonath et son équipe :
« Le protoribosome est né de l’auto-assemblage d’un groupe de chaînes de nucléotides d’ARN en deux parois semi-symétriques qui se sont accrochées pour créer une poche. D’innombrables autres structures ont dû s’assembler accidentellement au même moment, mais le protoribosome a survécu, en devenant « viral », semble-t-il, parce qu’il remplissait des fonctions utiles et, grâce aux capacités intrinsèques de l’ARN, il pouvait s’auto-répliquer. Lorsque deux acides aminés activés interagissent par hasard l’un avec l’autre dans cette poche, ils forment une liaison, facilitée par les conditions chimiques dominantes. Ces acides aminés peuvent être apparus sur Terre ou, comme certains le prétendent, avoir atterri avec des astéroïdes venus de l’espace, mais leur origine n’a rien à voir avec notre histoire. Ce qui importe, c’est qu’au sein du protoribosome, deux acides aminés activés pouvaient se lier l’un à l’autre. Plus tard, une telle liaison a uni de nombreux autres acides aminés, les reliant en une chaîne.
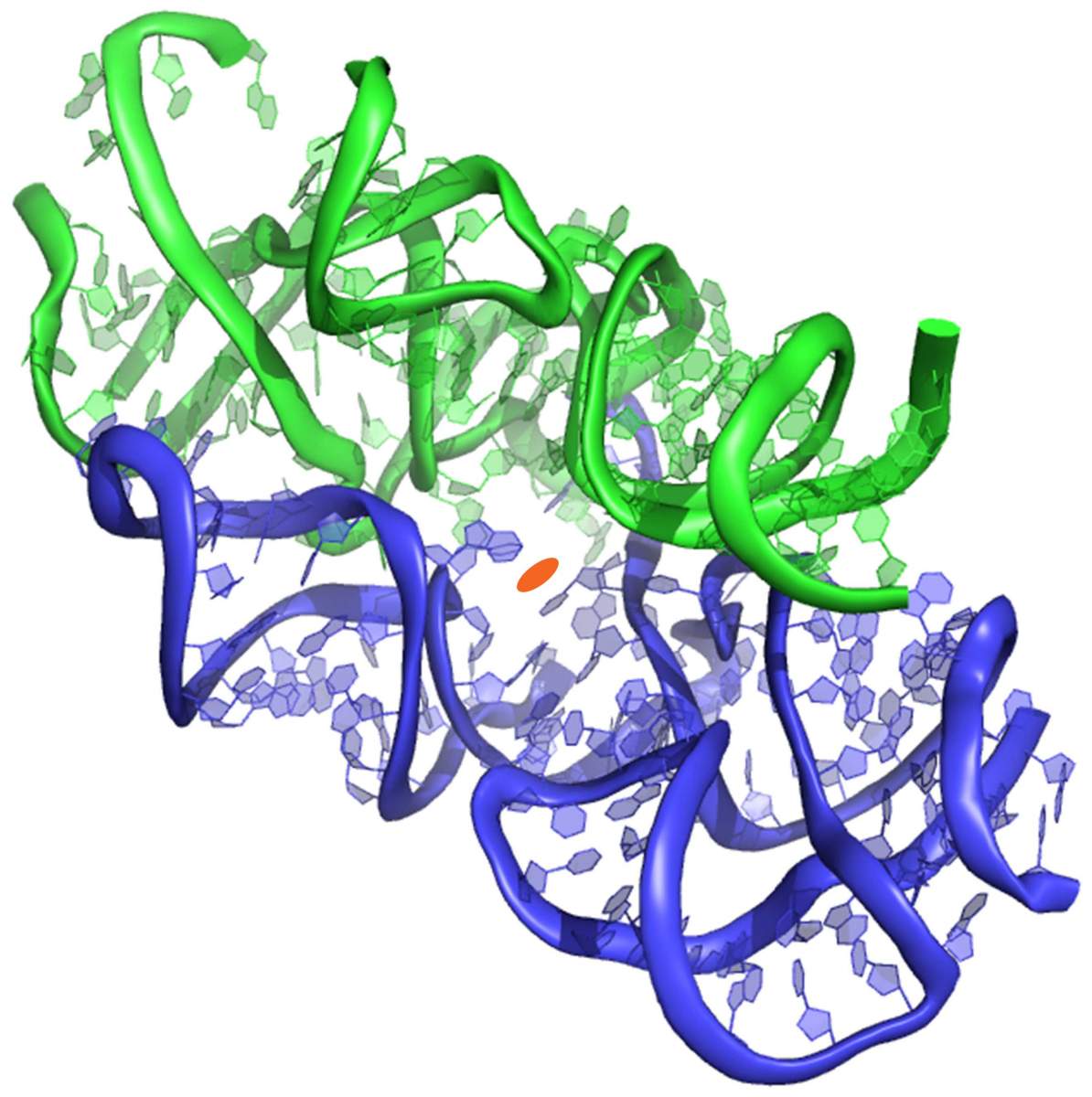
structure 3D protoribosome
C’était le début des protéines, dont certaines se sont ensuite révélées utiles pour stabiliser et renforcer le protoribosome lui-même. Les protéines n’ont cessé de renforcer la structure du protoribosome, lui permettant d’évoluer vers l’usine sophistiquée de fabrication de protéines qu’il est aujourd’hui. « Le ribosome moderne peut être décrit comme un oignon, avec le protoribosome en son centre, entouré de couches supplémentaires qui ont été ajoutées au cours de l’évolution », explique le Prof. Yonath.
Avec le temps, la production de protéines allait devenir suffisamment efficace pour créer des chaînes pouvant atteindre des milliers d’acides aminés, et ce, conformément aux instructions inscrites dans le message génétique. Les dizaines de milliers de protéines du corps humain remplissent toutes des fonctions différentes, qu’il s’agisse d’hormones comme l’insuline, d’anticorps du système immunitaire ou de composants structurels des cellules et des tissus comme l’hémoglobine ou le collagène de la peau. Et elles ont toutes commencé par des liaisons qui, un jour, se sont formées par hasard au sein du protoribosome.
Avançons rapidement de quelques milliards d’années. La théorie a été confirmée par des calculs, des déductions et des expériences de dimérisation, dans lesquelles les scientifiques ont créé des constructions dimériques d’ARN, imitant le protoribosome proposé. Mais jusqu’à récemment, les principes de la théorie restaient, en fait, largement théoriques. Aujourd’hui, dans une nouvelle étude dirigée par le Dr Tanaya Bose, stagiaire postdoctorale dans le laboratoire du Prof. Yonath, les scientifiques lui ont apporté un soutien expérimental.

Prof. Ada Yonath. Photo by Dan Porges
Le Dr. Bose et ses collègues ont cherché à savoir si un protoribosome synthétisé en laboratoire serait suffisamment stable pour survivre et effectuer son présumé travail de liaison, c’est-à-dire qu’ils voulaient savoir s’il était effectivement capable d’assumer cette tâche. Avec les autres membres de l’équipe du Prof. Yonath, elle a dessiné un modèle de protoribosome potentiel en analysant les structures en forme de poche au cœur de plusieurs ribosomes bactériens. Le Dr. Bose a ensuite construit des protoribosomes en tube à essai selon ce modèle.
Vient ensuite l’étape cruciale : vérifier si les constructions dimères en forme de poche peuvent créer des liaisons entre les acides aminés. Après avoir mélangé les constructions avec une solution contenant des substrats d’acides aminés activés, ainsi que divers sels et autres réactifs, le Dr. Bose a soumis les produits de la réaction à une batterie de tests, dont une analyse par spectrométrie de masse. À la grande joie de l’équipe, les protoribosomes synthétiques créés en laboratoire ont été à la hauteur de la tâche. « La formation de liaisons peptidiques est l’activité la plus vitale de toute cellule, et nous avons montré qu’elle peut avoir lieu à l’intérieur d’un protoribosome », déclare le Dr. Bose.
« Le protoribosome proposé pourrait être le chaînon manquant entre un monde dominé par l’ARN – qui a pu exister avant l’apparition des protéines et de l’ADN – et la vie basée sur les protéines et les acides nucléiques, telle que nous la connaissons aujourd’hui », explique le docteur Bashan.
La Science en nombres
À tout moment, la plupart des cellules humaines contiennent quelque 10 000 000 de ribosomes chacune. Tous les quatre jours environ, tous les ribosomes d’une cellule sont décomposés et de nouveaux sont construits ; la construction des ribosomes requiert 60 % de l’énergie de la cellule.


