
17 Nov Créer des cellules qui peuvent être tout et plus encore
La suppression d’un « verrou » récemment découvert dans l’ empaquetage de l’ADN peut redonner des capacités illimitées aux premières cellules.
Malgré tout l’enthousiasme suscité par le potentiel de guérison des cellules souches embryonnaires et leur capacité à se transformer en n’importe quel type de tissu corporel, ces cellules ne sont étonnamment pas les lauréates du prix des « possibilités infinies ». Ce prix revient aux cellules encore plus précoces qui composent l’embryon au cours du premier ou du deuxième jour de son existence. Des chercheurs de l’Institut Weizmann des Sciences viennent de révéler comment ces premières cellules commencent à abandonner leurs capacités illimitées et, ce qui est tout aussi important, comment ces capacités peuvent être restaurées.
« Nous avons découvert un nouveau mécanisme qui peut ramener les cellules à la toute première étape de la vie d’un embryon », explique le Dr Yifat Merbl, du Département d’Immunologie des Systèmes, qui a dirigé l’équipe de recherche avec le professeur Jacob Hanna, du Département de Génétique Moléculaire.
Lorsqu’un embryon est constitué de deux cellules, ces cellules possèdent une propriété appelée totipotence, ou capacité de tout faire. Ces cellules sont capables de se transformer non seulement en tous les types de tissus corporels mais aussi en placenta. Lorsque l’embryon atteint le stade de quatre cellules, certaines de ses cellules commencent à perdre leur totipotence et deviennent pluripotentes, c’est-à-dire qu’elles peuvent donner naissance à n’importe quel type de tissu corporel, mais pas au placenta.

De gauche à droite : Dr.Daoud Sheban, Dr. Yifat Merbl, Prof. Jacob Hanna
Au fur et à mesure que le processus se poursuit, l’embryon précoce se transforme en un amas de plusieurs dizaines de cellules souches pluripotentes, qui continuent à se diviser et finissent par se transformer en cellules nerveuses, musculaires et autres. Dans la nature, bien sûr, ce processus se déroule dans un seul sens, de l’œuf fécondé aux nombreuses cellules qui assument des tâches de plus en plus spécialisées. Mais dans le cadre de recherches qui leur ont valu le prix Nobel en 2012, des scientifiques ont montré qu’en laboratoire, cette spécialisation cellulaire est réversible : en introduisant quelques gènes dans des cellules matures, ils les ont reprogrammées pour qu’elles reviennent à un état non spécialisé, pluripotent.
Aujourd’hui, les chercheurs de Weizmann ont trouvé un nouveau moyen de pousser cette reprogrammation encore plus loin, en ramenant les cellules souches embryonnaires pluripotentes à un état totipotent, à deux cellules. Les scientifiques ont accompli cet exploit en manipulant un nouveau type de mécanisme qu’ils ont découvert : un changement dans la forme de l’empaquetage de la chromatine de l’ADN qui fait perdre aux cellules leur capacité de totipotence, commençant ainsi à modeler leur destin et leur identité future.
« Ce mécanisme est une sorte de verrou qui aide à maintenir le développement dans une seule direction », explique le Dr Daoud Sheban, qui a dirigé l’étude dans le cadre de ses études de doctorat dans les laboratoires du Dr. Merbl et du Prof. Hanna. « Il condense physiquement la chromatine, empêchant l’ADN de la cellule d’exprimer les gènes qui ont été identifiés comme étant liés à la totipotence. Une fois que nous avons inversé la condensation, la chromatine s’ouvre, ce qui provoque le déverrouillage. »
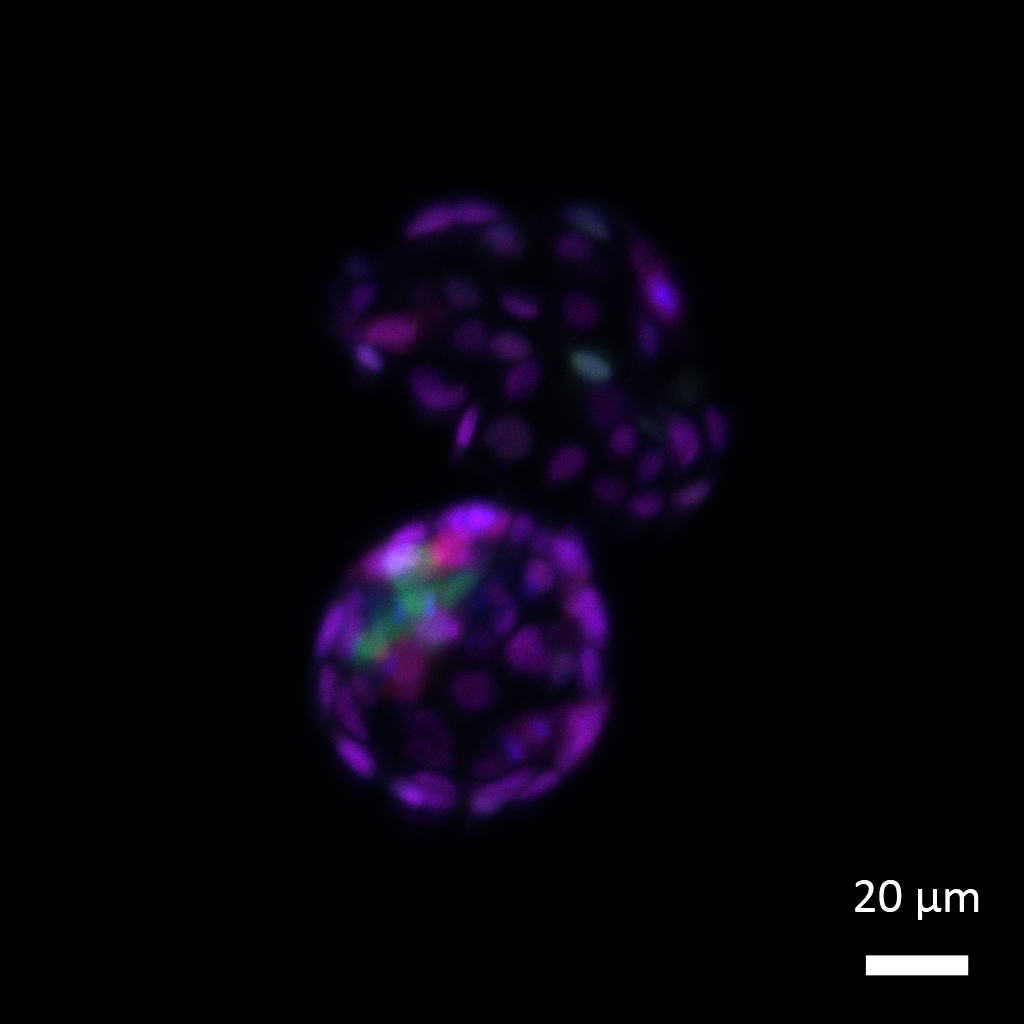 Après le retrait de l’étiquette SUMO des protéines, les cellules souches embryonnaires retrouvent leurs caractéristiques de totipotence et leur capacité à former à la fois la lignée cellulaire embryonnaire (bleu-vert) qui donnera naissance à tous les types de tissus de l’organisme et la lignée cellulaire extra-embryonnaire (violet) qui donnera naissance au futur placenta.
Après le retrait de l’étiquette SUMO des protéines, les cellules souches embryonnaires retrouvent leurs caractéristiques de totipotence et leur capacité à former à la fois la lignée cellulaire embryonnaire (bleu-vert) qui donnera naissance à tous les types de tissus de l’organisme et la lignée cellulaire extra-embryonnaire (violet) qui donnera naissance au futur placenta.
En faisant des expériences sur des embryons et des cellules souches de souris, le Dr. Sheban et ses collègues ont révélé comment la disposition spatiale de la chromatine est modifiée pour la rendre condensée : l’un de ses composants protéiques, appelé histone H1, est marqué par une protéine appartenant à une famille de petits modificateurs de type ubiquitine, ou SUMO. Au lieu de marquer les protéines pour la dégradation, comme le fait sa célèbre cousine l’ubiquitine, SUMO modifie leur fonction.
Le marquage par SUMO est l’une des nombreuses modifications que les protéines peuvent subir à un stade relativement tardif, à savoir une fois qu’elles sont entièrement synthétisées. Comme le montre le cas de l’histone H1, ce marquage peut avoir un effet décisif sur l’activité d’une protéine. « Indépendamment des niveaux de la protéine dans la cellule, sa fonction peut être régulée par des modifications tardives », explique Dr. Merbl.
Lorsque les scientifiques ont manipulé génétiquement des cellules souches embryonnaires pour éliminer les protéines histone H1 ou l’enzyme responsable du marquage SUMO, ces cellules sont redevenues totipotentes, retrouvant leur capacité à former du tissu placentaire. Non seulement leur chromatine s’est ouverte, mais plus d’une centaine de gènes impliqués dans la totipotence ont été à nouveau exprimés.
Les résultats de l’étude ouvrent de nouvelles voies de recherche sur le développement embryonnaire et les processus pathologiques, par exemple, les mécanismes sous-jacents du cancer. Les défauts dans le marquage SUMO pourraient être impliqués dans la perte d’identité des cellules cancéreuses, ce qui fait que ces cellules reviennent à un état immature caractérisé par une croissance agressive. L’étude pourrait également avoir des répercussions sur la médecine régénérative en jetant un nouvel éclairage sur les modes de maturation et de spécialisation des cellules. Une telle compréhension approfondie pourrait, à son tour, contribuer à apporter une plus grande précision dans le domaine de la culture des tissus et d’organes à des fins thérapeutiques.
« Nos résultats pourraient ajouter un nouvel outil à utiliser dans la régénération des tissus – débloquer la chromatine d’une cellule pour créer une disposition spatiale souhaitée », déclare Sheban.
La Science en chiffres
Même après la fabrication des protéines, leur fonction peut être altérée par plus de 200 types d’étiquettes moléculaires, ou modifications, comme SUMO ou sa cousine l’ubiquitine.
Les recherches du Dr Merbl sont soutenues par le Dr Celia et le Dr Lutz Zwillenberg-Fridman et Miel de Botton. Le Dr Merbl est titulaire de la Chaire de Développement de Carrière Leonard et Carol Berall.


