07 Sep Sans ovule, sans sperme et sans utérus
Des modèles d’embryons de souris synthétiques créés uniquement à partir de cellules souches, hors de l’utérus
Cette méthode ouvre de nouvelles perspectives pour l’étude de l’auto-organisation des cellules souches en organes et pourrait, à l’avenir, contribuer à la production de tissus transplantables.
La rencontre d’un ovule et d’un spermatozoïde est une première étape nécessaire au début de la vie, et c’est aussi une première étape courante dans la recherche sur le développement embryonnaire. Mais dans une étude de l’Institut Weizmann des Sciences publiée dans Cell, des chercheurs ont fait pousser des modèles d’embryons synthétiques de souris en dehors de l’utérus en commençant uniquement par des cellules souches cultivées dans une boîte de Pétri – c’est-à-dire sans utiliser d’ovules fécondés. Cette méthode ouvre de nouveaux horizons pour l’étude de la manière dont les cellules souches forment divers organes dans l’embryon en développement, et pourrait un jour permettre de cultiver des tissus et des organes destinés à la transplantation en utilisant des modèles d’embryons humains synthétiques.
« L’embryon est la meilleure machine à fabriquer des organes et la meilleure imprimante 3D biologique. Nous avons essayé d’imiter ce qu’il fait », explique le professeur Jacob Hanna, du Département de Génétique Moléculaire de l’Institut Weizmann, qui a dirigé l’équipe de recherche. Il explique que les scientifiques savent déjà comment ramener des cellules matures à la l’état « souche » – les pionniers de cette reprogrammation cellulaire avaient remporté un prix Nobel en 2012. Mais aller dans la direction opposée, c’est-à-dire amener les cellules souches à se différencier en cellules spécialisées du corps, sans parler de former des organes entiers, s’est avéré beaucoup plus problématique. « Jusqu’à présent, dans la plupart des études, les cellules spécialisées étaient souvent soit difficiles à produire, soit aberrantes, et elles avaient tendance à former un méli-mélo plutôt que des tissus bien structurés adaptés à la transplantation. Nous avons réussi à surmonter ces obstacles en libérant le potentiel d’auto-organisation codé dans les cellules souches ».

L’équipe du Professeur Hanna s’est appuyée sur deux avancées antérieures de son laboratoire. La première consistait en une méthode efficace de reprogrammation des cellules souches pour les ramener à un état naïf – c’est-à-dire à leur stade le plus précoce – lorsqu’elles ont le plus grand potentiel pour se spécialiser en différents types de cellules. L’autre, décrite dans un article scientifique paru dans Nature en mars 2021, était le dispositif à commande électronique que l’équipe avait mis au point au cours de sept années d’essais et d’erreurs pour cultiver des embryons naturels de souris en dehors de l’utérus. Le dispositif maintient les embryons immergés dans une solution nutritive qui se renouvelle continuellement à l’intérieur de béchers, simulant la façon dont les nutriments sont fournis par le flux sanguin maternel au placenta, et contrôle étroitement l’échange d’oxygène et la pression atmosphérique. Dans la recherche précédente, l’équipe avait utilisé avec succès ce dispositif pour faire croître des embryons naturels de souris du 5ème au 11ème jour.
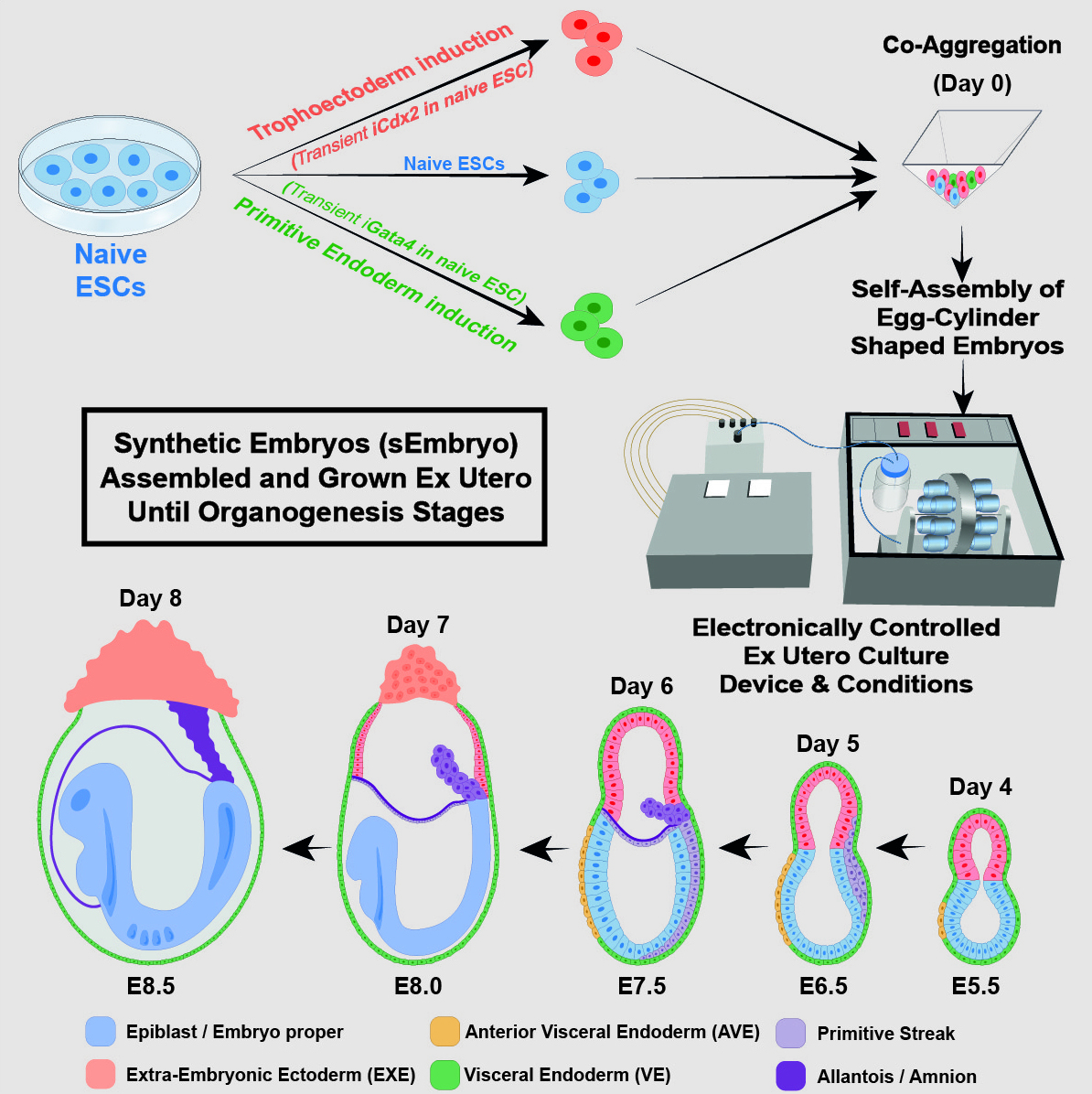
Dans la nouvelle étude, l’équipe a entrepris de cultiver un modèle d’embryon synthétique uniquement à partir de cellules souches naïves de souris cultivées pendant des années dans une boîte de Pétri, sans avoir besoin de le faire à partir d’un ovule fécondé. Cette approche est extrêmement précieuse car elle pourrait, dans une large mesure, contourner les problèmes techniques et éthiques liés à l’utilisation d’embryons naturels dans la recherche et la biotechnologie. Même dans le cas des souris, certaines expériences sont actuellement irréalisables car elles nécessiteraient des milliers d’embryons, alors que l’accès aux modèles dérivés de cellules embryonnaires de souris, qui se développent par millions dans des incubateurs de laboratoire, est pratiquement illimité.
Avant de placer les cellules souches dans le dispositif, les chercheurs les ont séparées en trois groupes. Dans le premier, qui contenait des cellules destinées à se développer en organes embryonnaires proprement dits, les cellules ont été laissées telles quelles. Les cellules des deux autres groupes ont été prétraitées pendant 48 heures seulement pour surexprimer l’un des deux types de gènes : les régulateurs principaux du placenta ou du sac vitellin. « Nous avons donné à ces deux groupes de cellules une impulsion transitoire pour donner naissance à des tissus extra-embryonnaires qui soutiennent l’embryon en développement », explique le Professeur Hanna.
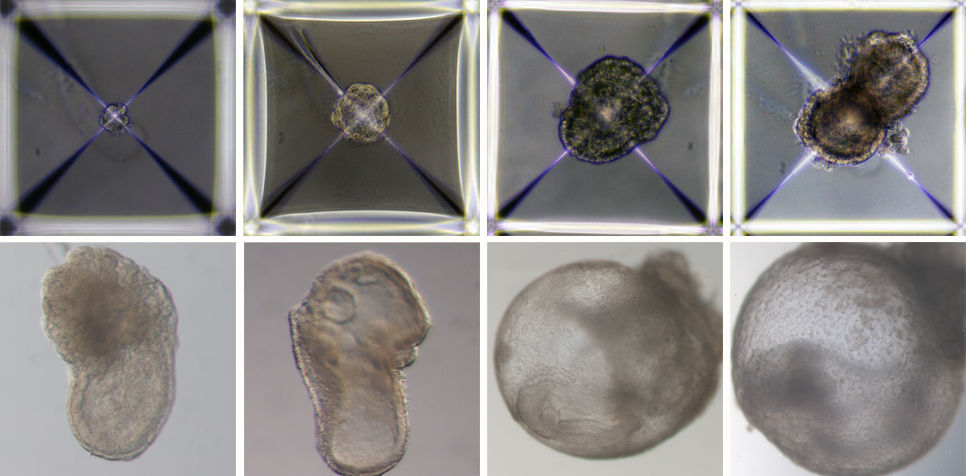
Peu après avoir été mélangés à l’intérieur du dispositif, les trois groupes de cellules se sont rassemblés en agrégats, dont la grande majorité n’a pas réussi à se développer correctement. Mais environ 0,5 % d’entre elles – 50 sur environ 10 000 – ont formé des sphères, chacune d’entre elles devenant ensuite une structure allongée ressemblant à un embryon.
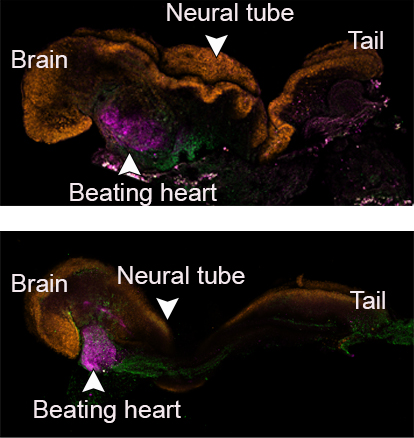
Comme les chercheurs avaient marqué chaque groupe de cellules d’une couleur différente, ils ont pu observer le placenta et les sacs vitellins se former à l’extérieur des embryons et le développement du modèle se dérouler comme dans un embryon naturel. Ces modèles synthétiques se sont développés normalement jusqu’au jour 8,5 – soit près de la moitié de la gestation de 20 jours de la souris – stade auquel tous les progéniteurs d’organes précoces se sont formés, y compris un cœur qui bat, une circulation de cellules souches sanguines, un cerveau avec des plis bien formés, un tube neural et un tube intestinal. Comparés aux embryons naturels de souris, les modèles synthétiques présentaient une similitude de 95 %, tant au niveau de la forme des structures internes que de l’expression génétique des différents types de cellules. Les organes observés dans les modèles donnaient tous les signes d’être fonctionnels.
Pour le Professeur Hanna et d’autres chercheurs spécialisés dans les cellules souches et le développement embryonnaire, cette étude ouvre de nouvelles perspectives : « Notre prochain défi est de comprendre comment les cellules souches savent ce qu’elles doivent faire, comment elles s’assemblent elles-mêmes en organes et trouvent leur chemin vers l’endroit où elles doivent être dans l’embryon. Et comme notre système, contrairement à un utérus, est transparent, il pourra se montrer utile pour modéliser l’apparition et l’implantation de défauts dans l’embryon humain ».
En plus de contribuer à réduire l’utilisation d’animaux dans la recherche, les modèles embryonnaires synthétiques pourraient à l’avenir devenir une source fiable de cellules, de tissus et d’organes pour les transplantations. « Au lieu de mettre au point un protocole différent pour cultiver chaque type de cellules – par exemple, celles du rein ou du foie – nous pourrons peut-être un jour créer un modèle embryonnaire synthétique, puis isoler les cellules dont nous avons besoin. Nous n’aurons pas besoin de dicter aux organes émergents comment ils doivent se développer. C’est l’embryon lui-même qui s’en charge le mieux. »
Cette recherche a été codirigée par Shadi Tarazi, Alejandro Aguilera-Castrejon et Carine Joubran du Département de génétique moléculaire de l’Institut Weizmann. Ont également participé à cette étude Shahd Ashouokhi, le Dr Francesco Roncato, Emilie Wildschutz, le Dr Bernardo Oldak, Elidet Gomez-Cesar, Nir Livnat, Sergey Viukov, Dmitry Lokshtanov, Segev Naveh-Tassa, Max Rose et le Dr Noa Novershtern du Département de génétique moléculaire à Weizmann ; Montaser Haddad et le Prof. Tsvee Lapidot du Département d’immunologie et de biologie régénérative de l’Institut Weizmann ; le Dr Merav Kedmi du Département des installations de base des sciences de la vie de l’Institut Weizmann ; le Dr Hadas Keren-Shaul du Nancy and Stephen Grand Israel National Center for Personalized Medicine ; et les Dr Nadir Ghanem, Suhair Hanna et Itay Maza du Rambam Health Care Campus.
Les recherches du professeur Jacob Hanna sont soutenues par le Dr Barry Sherman Institute for Medicinal Chemistry, le Helen and Martin Kimmel Institute for Stem Cell Research et Pascal et Ilana Mantoux.


