11 Juil Concevoir des protéines devient beaucoup plus facile
Oubliez les cristaux. L’IA donne aux algorithmes de Weizmann les moyens de concevoir des biomolécules dotées d’un large éventail de fonctions utiles.
Lorsque le Docteur Shiran Barber-Zucker a rejoint le laboratoire du Professeur Sarel Fleishman en tant que boursière postdoctorale, elle a choisi de poursuivre un rêve environnemental : décomposer les déchets plastiques en produits chimiques utiles.
La nature a en effet des moyens astucieux pour décomposer des matériaux résistants : Les arbres morts, par exemple, sont recyclés par les champignons de la pourriture blanche, dont les enzymes dégradent le bois en nutriments qui retournent au sol.
Alors pourquoi ne pas inciter les mêmes enzymes à dégrader les déchets produits par l’homme ?
Le problème de Barber-Zucker était que ces enzymes, appelées peroxydases polyvalentes, sont notoirement instables. « Ces enzymes naturelles sont de véritables « prima donna » ; il est extrêmement difficile de travailler avec elles », explique le Professeur Fleishman, du Département des Sciences Biomoléculaires de l’Institut Weizmann des Sciences.
Au cours des dernières années, son laboratoire a mis au point des méthodes de calcul qui sont utilisées par des milliers d’équipes de recherche dans le monde pour concevoir des enzymes et d’autres protéines présentant une stabilité accrue et d’autres propriétés souhaitées. Toutefois, pour que ces méthodes puissent être appliquées, la structure moléculaire précise d’une protéine doit être connue. Cela signifie généralement que la protéine doit être suffisamment stable pour former des cristaux, qui peuvent être bombardés de rayons X pour révéler leur structure en 3D.
Cette structure est ensuite modifiée à l’aide des algorithmes du laboratoire pour concevoir une protéine améliorée qui n’existe pas dans la nature. Mais si la protéine originale ne peut même pas être produite en laboratoire ou est trop fragile pour former des cristaux, comme c’est le cas des peroxydases polyvalentes, ces tentatives d’amélioration peuvent se heurter à une impasse.
Le Dr. Shiran Barber-Zucker a néanmoins tenté sa chance avec les prima donna enzymatiques et son timing était étrange.
Depuis les années 1980, des tentatives ont été faites pour contourner la nécessité de la cristallisation en prédisant la structure 3D d’une protéine à partir de sa séquence d’ADN, mais pour les protéines complexes comme les peroxydases, ces prédictions n’étaient pas fiables. Pourtant, à la fin de l’année 2020, quelques semaines après s’être lancée dans son projet, les structures enzymatiques prédites par le Dr. Barber-Zucker semblaient soudain étonnamment fiables. Il s’est avéré qu’à ce moment-là, DeepMind, la société de Google, et plusieurs équipes de recherche universitaires avaient amélioré les méthodes de prédiction des structures basées sur l’intelligence artificielle (IA) au point de les rendre très précises. Cela a changé la donne : L’approche a permis de prédire des modèles presque aussi précis que ceux obtenus expérimentalement par cristallographie.
Armés de ces nouvelles structures, le Dr. Shiran Barber-Zucker et ses collègues – Vladimir Mindel et Jonathan J. Weinstein, étudiants en recherche dans le laboratoire du Prof. Fleishman, ainsi que le Professeur Miguel Alcalde et le Docteur Eva García Ruiz de l’Institut de Catalyse de Madrid – ont réalisé l’impensable. Une seule enzyme de la famille des peroxydases polyvalentes avait déjà été décrite structurellement par des chercheurs, et ce projet avait nécessité une équipe d’experts pendant environ dix ans. Maintenant, en moins de six mois et sans aucune expertise préalable sur les enzymes dégradant le bois, le Dr. Barber-Zucker et ses collègues ont réussi à concevoir, produire et analyser des variantes stables de trois peroxydases polyvalentes dont les versions originales n’auraient pas pu, par le passé, être produites en laboratoire. Les scientifiques ont utilisé des modèles 3D basés sur l’IA comme point de départ. Ils ont appliqué à ces modèles un algorithme créé dans le laboratoire du Prof. Fleishman, appelé Protein Repair One Stop Shop, ou PROSS, qui conçoit une protéine modifiée sur ordinateur afin d’améliorer ses propriétés à la demande.
Cette approche combinée ouvre un énorme éventail de possibilités. « Des millions de protéines potentiellement précieuses, auxquelles il était autrefois impossible d’accéder par voie biochimique, sont désormais à portée de main pour la recherche et l’utilisation en biomédecine et en chimie », déclare M. Fleishman. Il fait référence au fait que les structures 3D ont été résolues expérimentalement pour moins de 0,05 % des millions de protéines naturelles dont la séquence d’ADN est connue, et qu’environ la moitié des protéines naturelles ne peuvent être exprimées et testées efficacement en laboratoire. « Ces protéines sont la matière noire de la biologie : les scientifiques n’ont aucun moyen de déterminer avec précision ce qu’elles font. Dans les études antérieures de conception de protéines, notre première question était : « Avons-nous une structure de la protéine sur laquelle nous voulons nous concentrer ? » Mais aujourd’hui, cette question est devenue sans objet ; nous pouvons nous débrouiller avec une structure ou sans, et c’est un véritable tournant. »

Dr. Shiran Barber-Zucker et Prof Sarel Fleishman
La conception de médicaments est un domaine qui pourrait immédiatement bénéficier de cette avancée. Par exemple, les anticorps créés chez les animaux de laboratoire doivent être adaptés à l’homme avant de pouvoir être utilisés dans un cadre clinique – un processus laborieux qui implique la cristallisation de la protéine et la modification de nombreuses régions de la molécule animale. Cette nouvelle avancée devrait rendre ce processus et d’autres processus d’ingénierie des anticorps beaucoup plus efficaces et productifs.
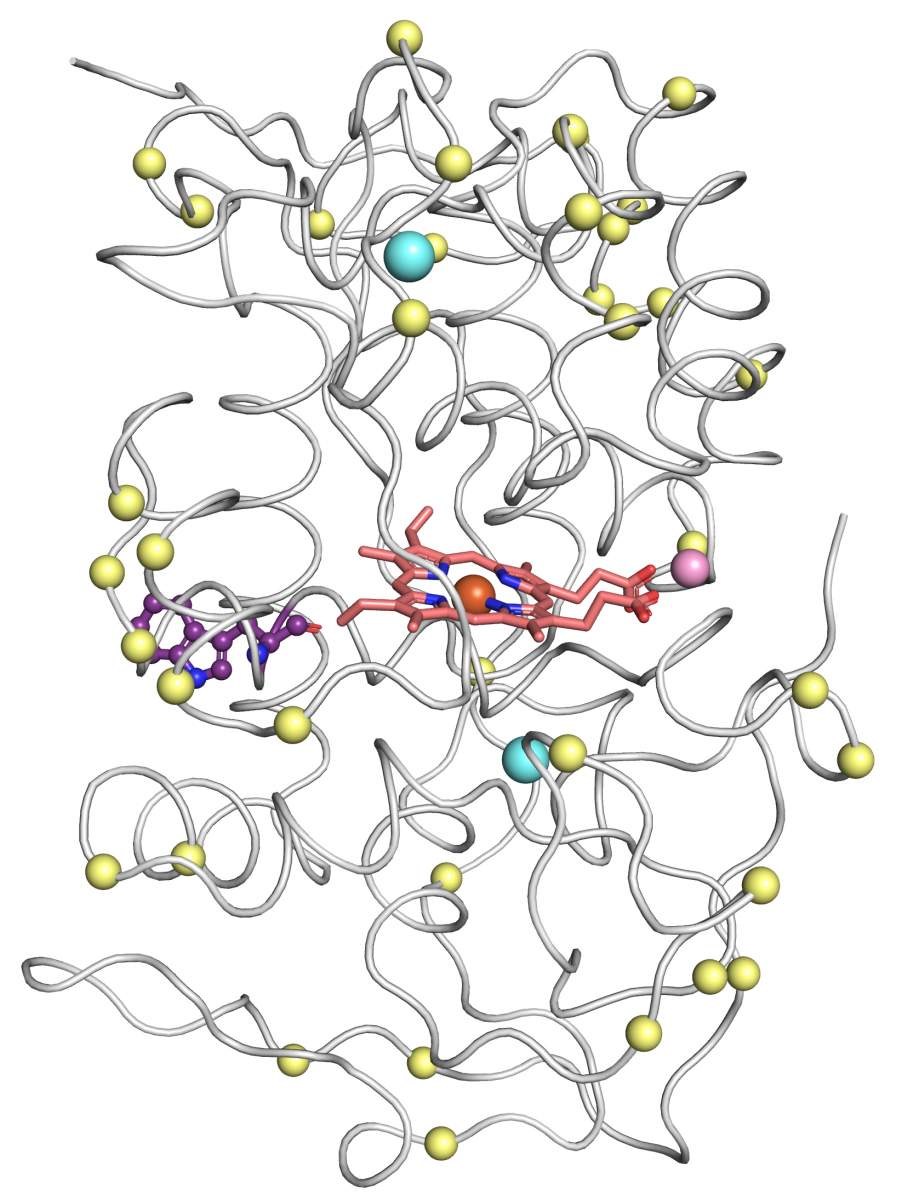
Modèle en 3D d’un enzyme peroxydase versatile généré par un concepteur de structure utilisant l’IA. Les points jaunes sont des sites de mutation suggérés par PROSS pour améliorer la stabilité de l’enzyme
Les applications environnementales, dont les perspectives sont à l’origine de cette étude, constituent une voie prometteuse. Les enzymes dégradant le bois pourraient, par exemple, être adaptées au recyclage des déchets agricoles tenaces. Au lieu de brûler ces déchets ou de les dissoudre avec des produits chimiques polluants, comme c’est souvent le cas aujourd’hui, il pourrait être possible, à l’aide de peroxydases polyvalentes, de les décomposer en sucres pouvant être fermentés en biocarburant. Les agriculteurs seraient alors en mesure d’effectuer le recyclage dans de petits bioréacteurs.
Les enzymes pourraient également être conçues pour dégrader les polluants environnementaux. En fait, le Dr. Barber-Zucker a déjà montré que ses enzymes améliorées peuvent s’attaquer à un colorant polluant particulièrement tenace. Elle a également constaté que chacune des trois enzymes améliorées présentait une activité différente en laboratoire, et que chacune se spécialisait dans la dégradation de différents composants du bois, ce qui suggère qu’elles pourraient agir en synergie. Fait important, les trois enzymes se sont révélées remarquablement stables et résistantes à la chaleur, une caractéristique essentielle pour leur utilisation dans l’industrie. Barber-Zucker vise maintenant à mettre au point un « cocktail » d’enzymes, dans lequel une douzaine d’enzymes différentes, y compris ses peroxydases polyvalentes, travailleront en synergie pour décomposer les déchets de bois en biocarburant ou autres matériaux utiles.
Et que dire de sa vision du recyclage des plastiques durs à l’aide de ces enzymes ? « C’est encore un rêve, mais qui pourrait devenir une réalité dans un avenir proche », dit-elle.


