28 Juin Hunger Games : découvrir le secret de l’interrupteur de la faim dans le cerveau
Une structure 3D révèle comment un interrupteur moléculaire unique dans notre cerveau provoque la sensation de satiété – et pourrait aider à développer des médicaments anti-obésité.
Avoir faim en permanence, quelle que soit la quantité de nourriture ingérée, est un problème quotidien pour les personnes atteintes d’un défaut génétique du contrôle de l’appétit dans le cerveau, ce qui se termine souvent par une obésité sévère. Dans une étude publiée dans Science le 15 avril dernier, des chercheurs de l’Institut Weizmann des Sciences en collaboration avec des collègues de l’université Queen Mary à Londres et de l’université hébraïque à Jérusalem, ont révélé le mécanisme d’action de l’interrupteur principal de la faim dans le cerveau : le récepteur de la mélanocortine 4, ou MC4. Ils ont aussi expliqué comment cet interrupteur est activé par le setmelanotide (sous le nom Imcivree), un médicament récemment autorisé pour le traitement de l’obésité sévère provoquée par des modifications génétiques. Ces découvertes expliquent la façon dont la faim est régulée et pourraient aider à développer des traitements anti-obésité améliorés.
Le récepteur du MC4 (appelé MC4-R) est présent dans une zone du cerveau appelée hypothalamus – au cœur d’un cluster de neurones qui calculent l’équilibre énergétique du corps en analysant un certain nombre de signaux métaboliques liés à l’énergie. Quand le MC4-R est à l’état actif – son état habituel – il envoie des données qui nous donnent une sensation de satiété ce qui signifie que, du point de vue du cerveau, notre état par défaut est cet état de satiété. Quand nos niveaux d’énergie baissent, le cluster hypothalamique produit une hormone nous indiquant qu’il est temps de manger. Cette hormone inactive le MC4-R, envoyant un signal nous disant « d’avoir faim ». Après avoir mangé, une seconde hormone disant « je suis rassasié » est libérée. Elle se lie au même site actif sur le MC4-R, remplaçant l’hormone de la faim et rallumant le récepteur – nous ramenant à notre état de satiété par défaut. Des mutations qui inactivent le MC4-R provoquent une faim permanente.
Le MC4-R est une cible de choix pour les médicaments anti-obésité comme le setmelanotide, car c’est un des interrupteurs principaux : l’allumer permet de contrôler la faim en bypassant tous les autres signaux relatifs à l’énergie. Mais jusqu’à présent, nous ne connaissions pas le fonctionnement exact de cet interrupteur de la faim.
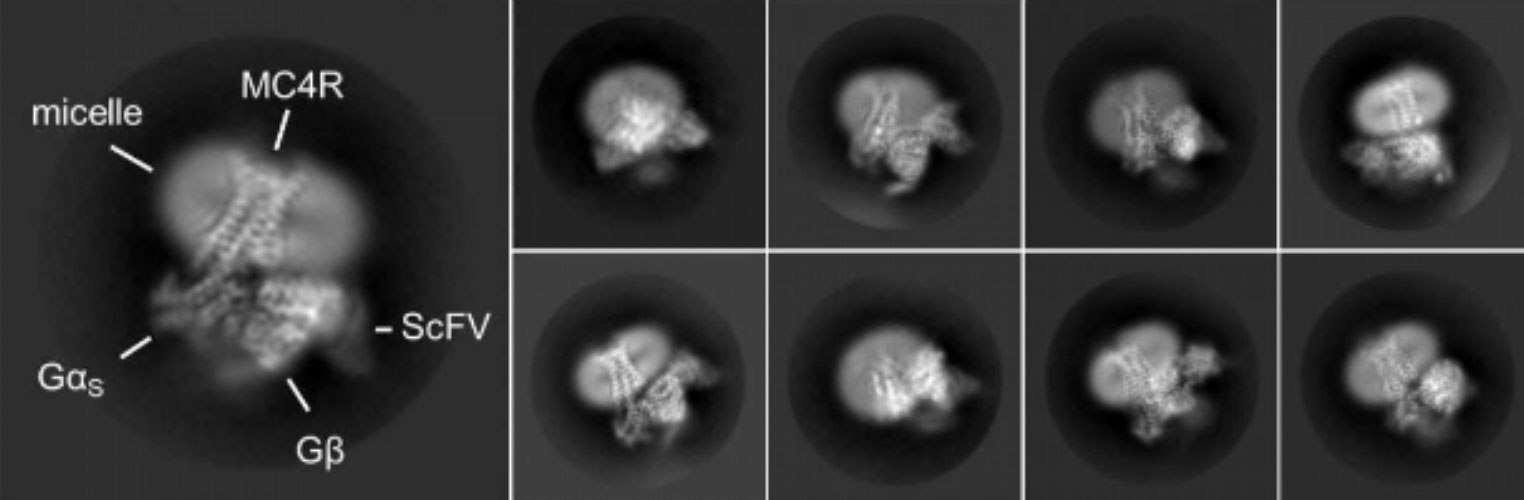
Images de microscopie électronique représentant différentes vues du MC4-R lié au setmelanotide, en complexe avec des protéines activées par la liaison
Cette nouvelle étude a débuté avec les difficultés d’une famille dont au moins 8 des membres étaient atteints de faim persistante et d’obésité sévère – la plupart d’entre eux avec un indice de masse corporelle (IMC) supérieur à 70, ce qui est environ trois fois supérieur à la normale. Leur histoire médicale a attiré l’attention d’Hadar Israeli, une étudiante en doctorat de médecine s’intéressant aux mécanismes de l’obésité sous la supervision du docteur Danny Ben-Zvi à l’Université Hébraïque de Jérusalem. Hadar Israeli était frappée par le fait que la situation de la famille était due à une simple mutation affectant le MC4. Elle s’est tournée vers le docteur Moran Shalev-Benami du Département de Biologie Structurelle et Chimique de l’Institut Weizmann pour savoir si de nouvelles avancées en microscopie électronique pourraient aider à expliquer comment cette mutation précise pouvait produire un effet si dévastateur.
Le docteur Shalev-Benami a décidé de lancer une étude sur la structure du MC4, invitant Hadar Israeli à rejoindre son laboratoire en tant que scientifique invité. En collaboration avec le docteur Oksana Degtjarik, en postdoctorat dans le laboratoire, Hadar Israeli a isolé de grandes quantités de MC4-R pur provenant de membranes cellulaires, a laissé ce MC4-R purifié se lier avec du setmelanotide et a déterminé sa structure 3D en utilisant de la microscopie électronique cryogénique. Cette étude a été menée en collaboration avec l’équipe du docteur Peter J. McCormick de l’université Queen Mary à Londres et celle du professeur Masha Y. Niv de l’université hébraïque à Jérusalem.
 (de gauche à droite) Docteur Oksana Degtjarik, docteur Moran Shalev-Benami et Hadar Israeli
(de gauche à droite) Docteur Oksana Degtjarik, docteur Moran Shalev-Benami et Hadar Israeli
La structure 3D a révélé que le setmelanotide activait le MC4-R en entrant dans sa poche de liaison – c’est-à-dire en appuyant directement sur l’interrupteur moléculaire signifiant la satiété, peut-être plus efficacement que l’hormone de satiété naturelle. Il est également apparu que le médicament avait un allié inattendu : un ion calcium qui entrait dans la poche et améliorait la liaison du médicament avec le récepteur. Lors d’expériences biochimiques et informatiques, les scientifiques ont découvert que, comme il le fait pour le médicament, le calcium aidait aussi l’hormone de satiété naturelle à se lier au MC4-R.
Le docteur McCormick explique : « Le calcium aide l’hormone de satiété à activer le MC4 en interférant avec l’hormone de la faim et en réduisant son activité. »
« C’était vraiment une découverte inattendue, » dit le docteur Shalev-Benami. « Apparemment, le signal de satiété peut vaincre le signal de faim grâce à l’aide du calcium qui aide le cerveau à retrouver sa sensation de satiété après avoir mangé. »
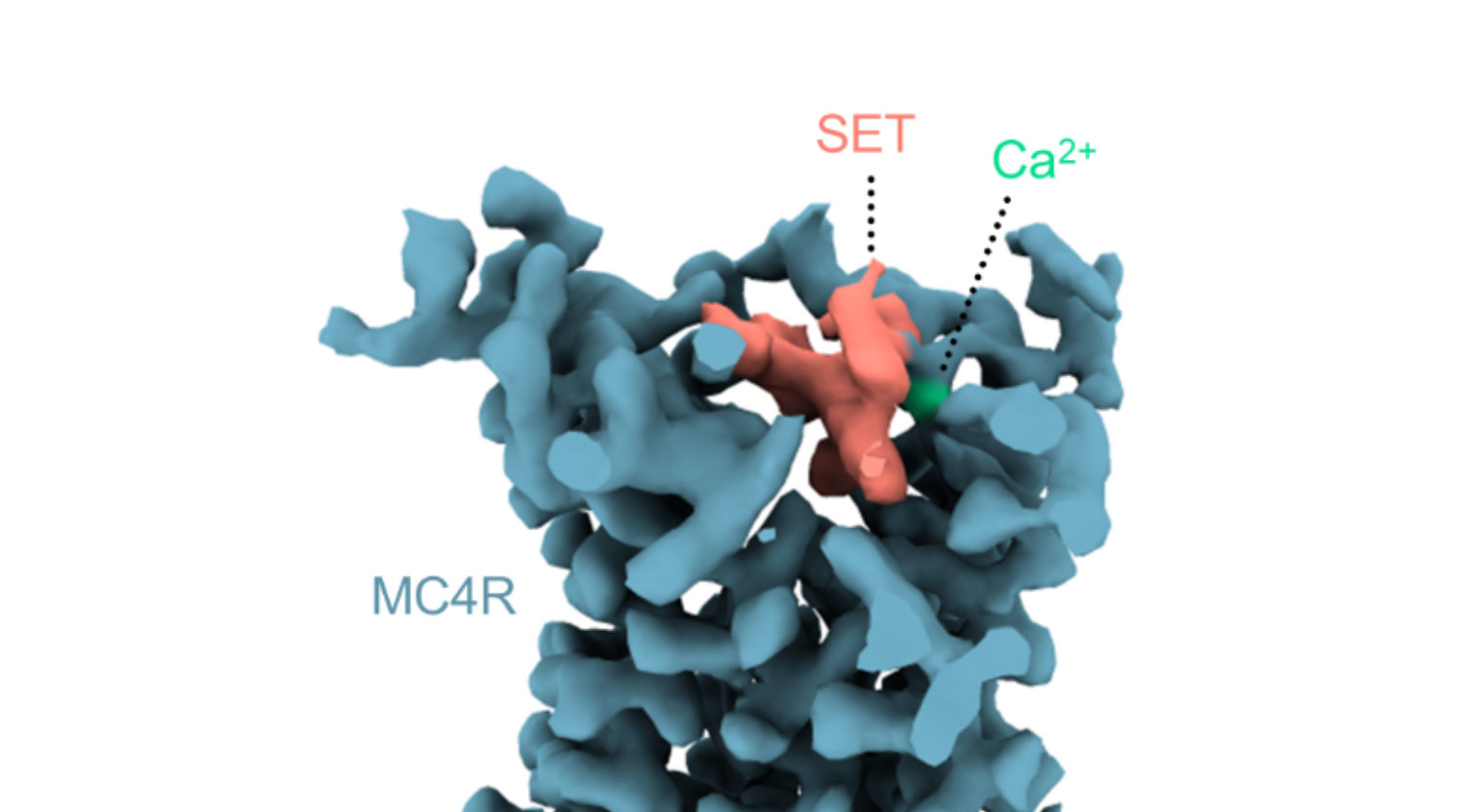
Structure 3D montrant la molécule setmelanotide (rose) et un ion calcium (vert) dans la poche de liaison du MC4-R
La structure du MC4-R a également révélé que l’entrée du médicament provoque des changements de structure du chez le récepteur : ces changements semblent initier les signaux dans les neurones qui conduisent à une sensation de satiété. L’étude explique comment des mutations du MC4-R peuvent interférer avec cette signalisation, menant à une faim sans limite et finalement l’obésité.
Les scientifiques ont en outre identifié des points sensibles qui distinguent le MC4-R de récepteurs similaires de la même famille. Cela permettra peut-être de concevoir des médicaments qui ne se lieront qu’au MC4-R, évitant les effets secondaires qui peuvent être provoqués par des interactions avec d’autres récepteurs.
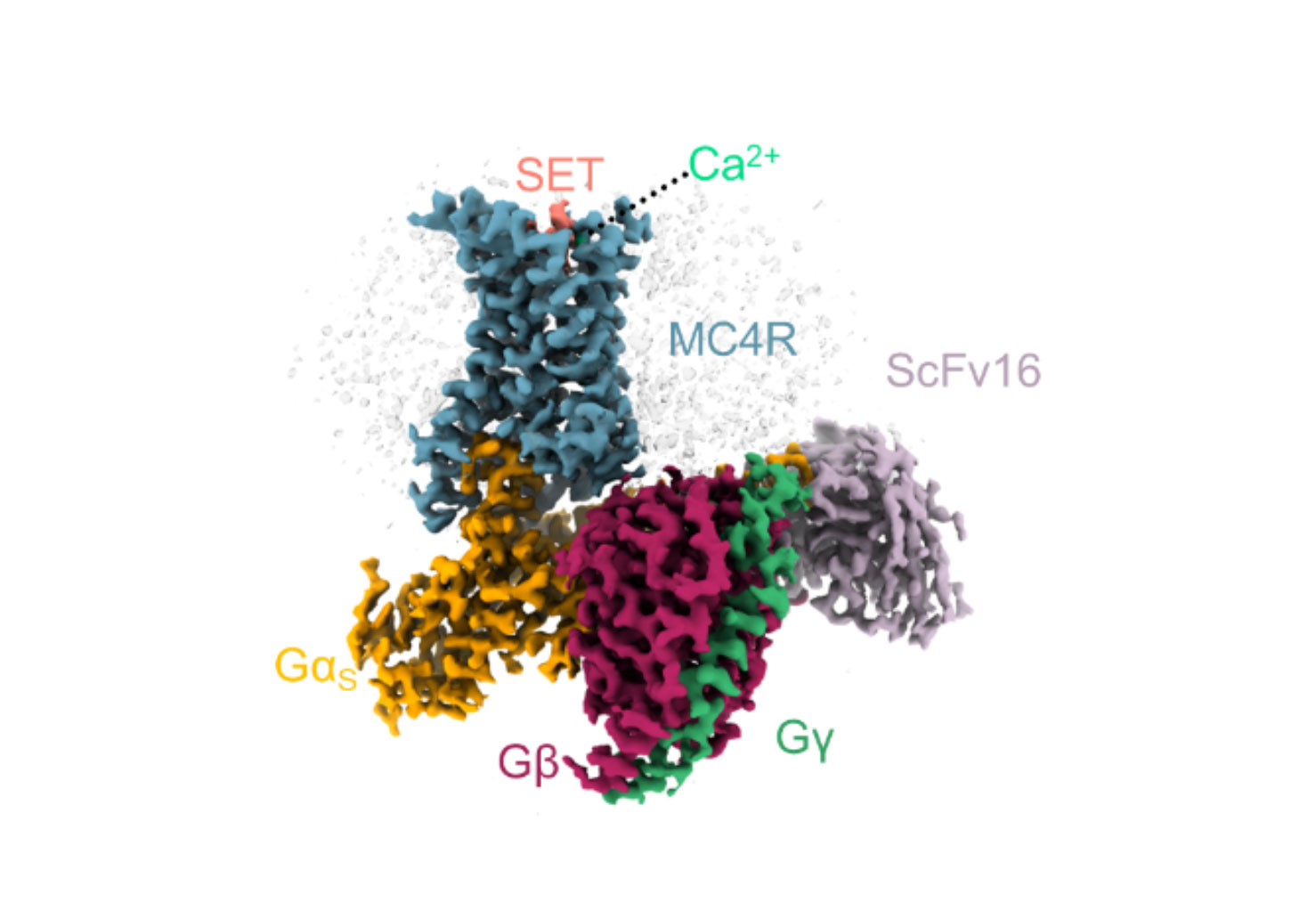 Structure 3D d’un complexe formé par le MC4-R (bleu) et plusieurs protéines qu’il active, avec une molécule de setmelanotide (rose) et un ion calcium (vert), dans la poche de liaison du MC4-R
Structure 3D d’un complexe formé par le MC4-R (bleu) et plusieurs protéines qu’il active, avec une molécule de setmelanotide (rose) et un ion calcium (vert), dans la poche de liaison du MC4-R
« Nos découvertes peuvent aider à développer des médicaments anti-obésité améliorés et plus sûrs qui cibleront le MC4 avec une meilleure précision, » dit le docteur Shalev-Benami.
Les recherches du docteur Moran Shalev-Benami sont financées par la chaire Tauro pour le Développement de Carrière en Recherche Biomédicale, l’Institut Ilse Katz pour la Recherche en Science des Matériaux et en Résonnance Magnétique, le Zuckerman STEM Leadership Program, le Laboratoire Joseph et Wolf Lebovic et la Fondation Abisch Frenkel pour la Promotion des Sciences de la Vie.


