28 Mai Le détournement des défenses de leur hôte donnent l’avantage aux bactéries
Un interrupteur métabolique présent chez les macrophages combattant les microbes indique aux bactéries quand les transformer en hôtels de luxe
Les bactéries qui provoquent parfois des infections mortelles utilisent le pire des stratagèmes : voler les armes de défense du corps humain et les exploiter à leurs fins. Des chercheurs de l’Institut Weizmann des Sciences ont découvert une de ces stratégies utilisée par la salmonelle.
La salmonelle est une bactérie qui pénètre les intestins humains puis provoque des diarrhées et d’autres symptômes d’intoxication alimentaire généralement modérés. Mais si elle atteint le flux sanguin et contamine le foie, la rate et d’autres organes, elle peut provoquer des maladies plus graves qui peuvent être fatales. Dans ces cas-là, de grandes cellules protectrices appelées macrophages essaient de stopper l’infection en avalant les salmonelles. Mais il arrive que les bactéries non seulement survivent à l’intérieur de ces macrophages mais parviennent même à s’y développer, les transformant en véritables incubateurs facilitant leur propagation.
Des macrophages, grandes cellules immunitaires, « avalent » des bactéries entières. Getty image
Dans une étude menée par le doctorant Gili Rosenberg du laboratoire du docteur Roi Avraham du Département de Régulation Biologique, les chercheurs ont commencé par exposer des macrophages à des salmonelles et ont examiné les changements qui se produisaient dans ces cellules. Quand les macrophages se préparent à se battre avec les bactéries, leur métabolisme subit un changement majeur : ils arrêtent de produire de l’énergie dans leurs organelles appelées mitochondries et se mettent à consommer une grande quantité de glucose. Quand les chercheurs ont bloqué ce changement métabolique chez les macrophages, ils ont découvert à leur grande surprise que les bactéries, plutôt que de devenir plus agressives, devenaient moins virulentes.
Cette découverte suggère que la virulence de la Salmonelle est liée d’une certaine façon à ce changement métabolique. En d’autres termes, les changements dans le métabolisme cellulaire censés aider les macrophages à combattre l’infection pourraient être piratés et utilisés par les salmonelles. Les scientifiques ont étudié tous les métabolites qui s’accumulent dans les macrophages quand ils combattent les salmonelles et se sont focalisés sur un composé appelé succinate. Ce composé est connu pour agir en tant que signal moléculaire utilisé par les macrophages pour activer leurs défenses contre les bactéries invasives. La succinate favorise la mobilisation du système immunitaire et la création de composés inflammatoires toxiques pouvant tuer les bactéries.

(de gauche à droite) Gili Rosenberg et le docteur Roi Avraham
Mais comme les scientifiques l’ont découvert, les bactéries – au cours de l’évolution – ont appris à utiliser ces molécules comme des signaux pour devenir plus agressives et manipuler le contenu des macrophages en leur faveur. Le succinate active certains gènes bactériens qui permettent aux Salmonelles de développer une aiguille qui perce l’enveloppe des vacuoles de phagocytose, des compartiments fermés à l’intérieur du macrophage dans lesquels il garde les bactéries prisonnières d’un capitonnage toxique. L’aiguille sécrète alors des substances qui neutralisent le mécanisme tueur de ces cellules géantes. Pour couronner le tout, le succinate active un mécanisme qui protège la salmonelle des peptides antimicrobiens sécrétés dans les macrophages ; la bactérie se retrouve donc comme chez elle dans cet hôtel de luxe.
Afin de confirmer que ces manipulations sont effectivement dépendantes du succinate, les scientifiques ont modifié génétiquement des salmonelles pour désactiver la molécule de transport qui leur permettait d’utiliser le succinate, puis ont comparé les bactéries mutantes aux bactéries classiques. Les bactéries mutantes n’ont pas survécu dans les macrophages et étaient bien moins efficaces pour infecter les souris que les bactéries classiques.
Cette étude apporte de nouvelles informations sur l’infection à salmonelles et ouvre la voie à des recherches similaires sur d’autres bactéries qui pourraient pirater les métabolites immunitaires qui s’accumulent dans les macrophages à la suite d’une infection bactérienne. Ce même procédé est peut-être utilisé par les bactéries responsables de la tuberculose, ou par la Listéria qui provoque une forme de méningite et d’autres infections graves, ou encore la Shigelle, une bactérie commune à l’origine de diarrhées infantile en Afrique et en Asie du sud.
Les découvertes de cette étude pourront peut-être servir de base pour le développement de thérapies antibactériennes en bloquant l’utilisation du succinate par les bactéries. De tels médicaments pourraient être mieux ciblés que les antibiotiques actuels.
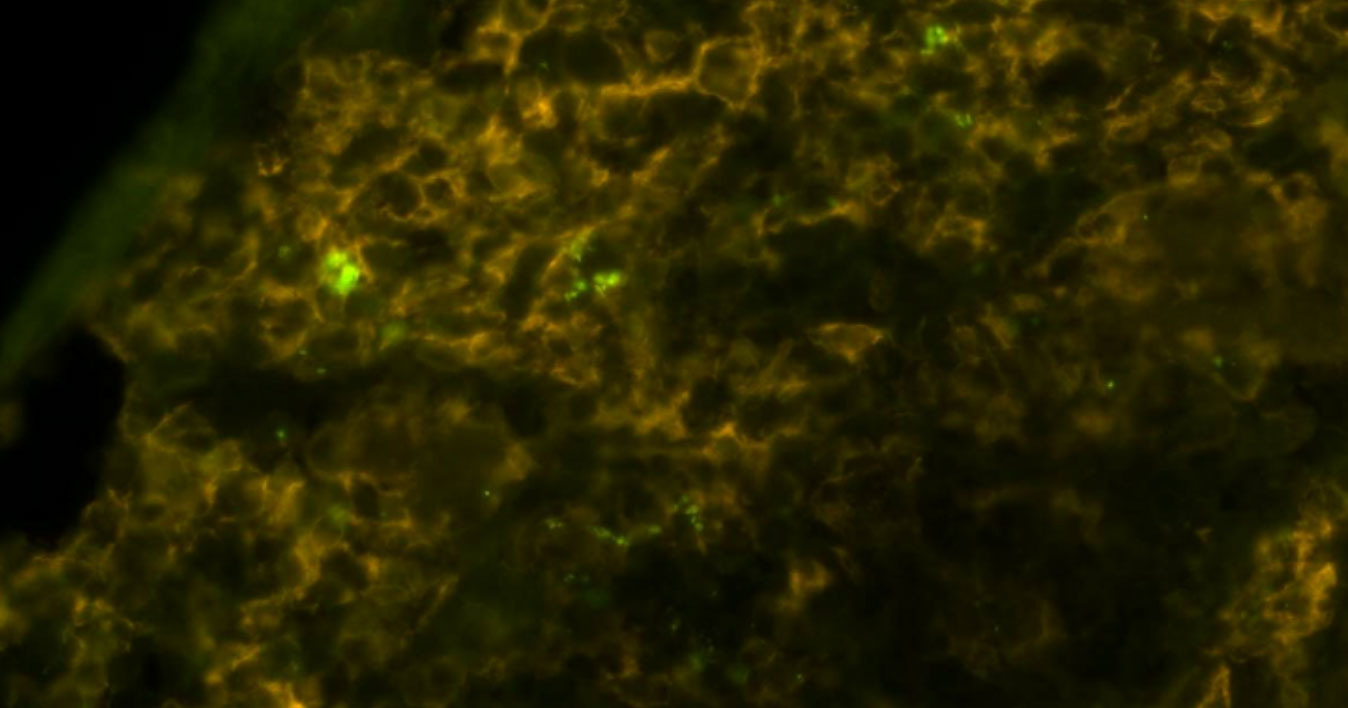
La salmonelle (vert brillant) dans les macrophages (jaune brunâtre) au microscope
« Alors que les antibiotiques tuent toutes les bactéries, les bonnes comme les mauvaises, une thérapie basée sur le blocage du succinate pourrait permettre de ne cibler que les bactéries qui provoquent la maladie, » dit Gili Rosenberg.
D’autres chercheurs ont également participé à cette étude : Dror Yehezkel, Dotan Hoffman, Leia Vainman, Noa Nissani, le docteur Shelly Hen-Avivi, le docteur Shirley Brenner, le docteur Noa Bossel Ben-Moshe et Hadar Ben-Arosh du Département de Régulation Biologique, les docteurs Maxim Itkin et Sergey Malitsky du Département du Plateau Technique des Sciences de la Vie.
Les recherches du docteur Roi Avraham sont financées par le Sagol Weizmann-MIT Bridge Program, le Conseil Pasteur-Weizmann, la succession Zvia Zeroni et le Conseil Européen pour la Recherche. Le docteur Avraham est détenteur de la chaire pour le développement de carrière Philip Harris et Gerald Ronson.


