06 Mai Nettoyer les décharges cellulaires pourrait être thérapeutique
Les détails d’un mécanisme d’adaptation cellulaire indiquent de nouvelles voies pour traiter la neurodégénérescence.
Gérer le stress est une compétence essentielle – non seulement pour nous, mais aussi pour nos cellules. Quand les cellules font face à des conditions extrêmement stressantes, elles produisent de petits amas temporaires appelés granules de stress qui les aident à gérer la chaleur, le froid ou d’autres circonstances potentiellement néfastes. Si ces granules ne sont pas démantelées après diminution du stress, elles peuvent s’emmêler, encombrer la cellule comme des épaves de voitures dans une décharge et les scientifiques pensent que cet encombrement peut entraîner une maladie neurodégénérative. Des chercheurs de l’Institut Weizmann des Sciences, en collaboration avec d’autres scientifiques, ont déchiffré le mécanisme moléculaire par lequel les granules de stress sont généralement démantelées et ont montré que jouer sur ce mécanisme peut bloquer la neurodégénérescence du type de celle observée dans la sclérose latérale amyotrophique ou SLA.
Les granules de stress sont constituées de molécules d’ARN messager et d’un assortiment de protéines qui y sont liées. La façon dont elles s’assemblent est déjà connue mais le processus inverse de démontage était inconnu. Le professeur Eran Hornstein du Département Génétique Moléculaire de l’Institut Weizmann et son équipe ont étudié ce processus inverse dans le but de comprendre ce qui se passe quand cela tourne mal. Des granules de stress anormales qui n’arrivent pas à se désassembler sont considérées comme les précurseurs des agrégats anormaux de protéines appelés inclusions, que l’on retrouve dans le cerveau de personnes atteintes de SLA et d’un certain nombre de maladies neurodégénératives comme un type fréquent de démence appelé dégénération fronto-temporale.

(de gauche à droite) : Yehuda Danino, docteur Tsviya Olender, Aviad Siany, professeur Eran Hornstein, Hagai Marmor-Kollet, Revital Ravid, Natali Rivkin et Chen Eitan
Hagai Marmor-Kollet et Aviad Siany, deux étudiants en mastère du laboratoire du professeur Hornstein, ont mené cette étude en collaboration avec le professeur Tamar Geiger de l’université de Tel Aviv et des chercheurs de la Harvard Medical School et de l’Université Catholique de Louvain. Les scientifiques ont développé de nouvelles méthodes permettant d’isoler jusqu’aux plus petits compartiments des cellules humaines et de marquer les protéines qui s’y trouvent pour qu’elles soient par la suite identifiables par spectroscopie de masse. Grâce à cette méthode, les chercheurs ont défini la composition des granules de stress, révélant ainsi des composants jusqu’ici inconnus, notamment plus de 100 nouvelles protéines et substructures microscopiques. En poursuivant leurs recherches, ils ont été surpris d’observer qu’au fil du désassemblage, des dizaines de protéines supplémentaires étaient enrôlées par les granules. Les scientifiques les ont appelées les « protéines engagées pour le désassemblage ».
Quand les scientifiques se sont concentrés sur la façon précise dont les protéines engagées pour le désassemblage dissolvaient les granules, ils ont identifié une nouvelle séquence de réactions biochimiques qui a elle-même apporté son lot de surprises. Il s’est avéré que les éléments clefs de cette séquence sont des marqueurs protéiques appelés SUMO (de l’anglais « small ubiquitin-like modifier », ce qui signifie « petits modificateurs similaires à l’ubiquitine ») qui sont connues pour remplir des fonctions totalement différentes au sein du noyau cellulaire.
Les scientifiques ont ensuite effectué une série d’expériences montrant que leurs découvertes étaient applicables aux maladies neurodégénératives humaines. Après avoir exposé des cellules à une protéine toxique connue pour provoquer la SLA chez l’être humain, ils ont découvert que les granules de stress ne se désassemblaient pas correctement dans ces cellules et que les protéines engagées pour le désassemblage, en particulier les enzymes SUMO, n’étaient pas enrôlées correctement. Plus important encore, les scientifiques ont réussi à bloquer la neurodégénérescence chez des drosophiles (mouches des fruits), génétiquement modifiées afin qu’elles développent une maladie similaire à la SLA, en introduisant les enzymes SUMO dans leur corps en dégénérescence.
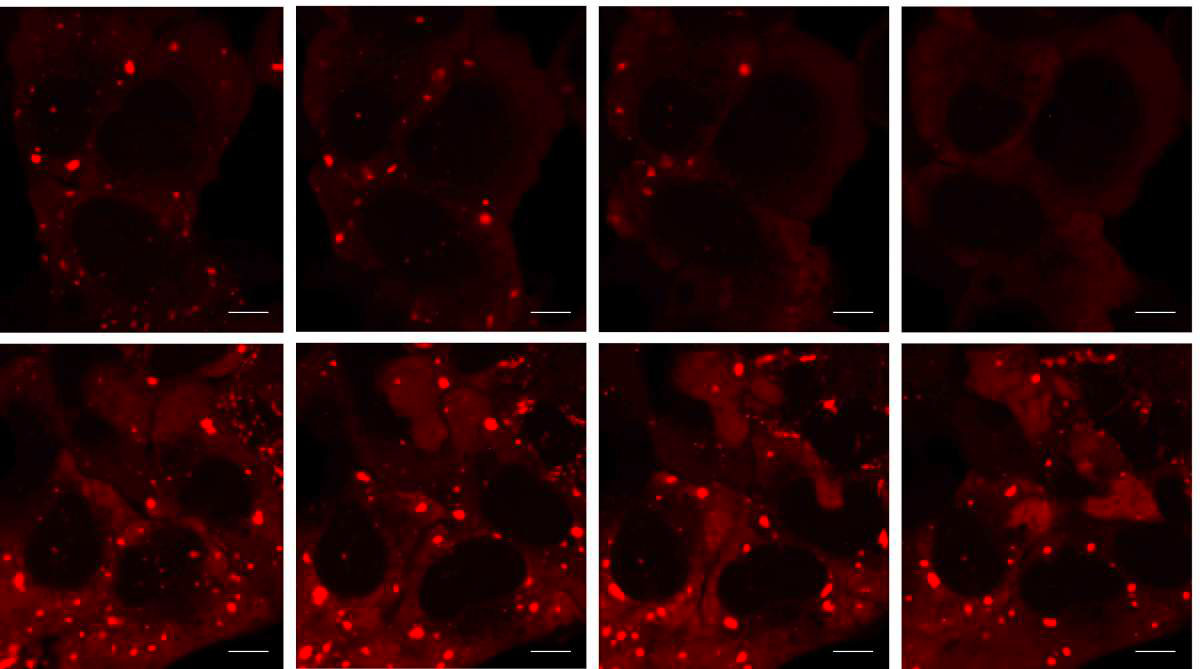
Les granules de stress (rouge brillant) qui se forment en cas de stress (à gauche, en haut et en bas) se désassemblent dans les cellules normales trois heures après la disparition du stress (en haut à droite) mais pas dans les cellules ne présentant pas d’enzymes SUMO (en bas à droite)
Ces découvertes ouvrent une nouvelle ligne de recherche sur les mécanismes sous-jacents à la SLA et à d’autres maladies neurodégénératives : comprendre comment les défauts d’un mécanisme adaptatif normal, à savoir la formation et le démantèlement des granules de stress, peut contribuer à ces troubles.
« Nous espérons que cette étude servira de base au développement de potentielles futures thérapies, » dit le professeur Hornstein. « Nos découvertes nous orientent vers une nouvelle façon de combattre la neurodégénérescence – en renforçant l’activité des enzymes SUMO. »
Le laboratoire du professeur Hornstein étudie la SLA depuis de nombreuses années et développe de nouvelles thérapies. L’une des thérapies candidates est actuellement en phase II d’un essai clinique sur des patients atteints de SLA à l’Institut neurologique de Montréal. Une autre thérapie potentielle est en phase préclinique de développement. Ces deux thérapies sont basées sur des mécanismes moléculaires liés au micro-ARN.
Ont aussi participé à cette étude : Natalia Rivkin, Yehuda M. Danino, le docteur Tsviya Olender, Daoud Sheban, Nir Cohen, Revital Ravid, Chen Eitan, le docteur Beata Toth Cohen et le professeur Jacob H. Hanna du Département de Génétique Moléculaire de l’Institut Weizmann, le docteur Tali Dadosh du Département Support Chimie de l’Institut Weizmann, le docteur Yoseph Addadi du Département des Plateformes Techniques de la Faculté des Sciences de la Vie de l’Institut Weizmann, le docteur Yifat Merbl du Département d’Immunologie de l’Institut Weizmann, le docteur Nancy Kedersha, Sarah Hofmann, Claire L. Riggs, le docteur Vivek M. Advani, le professeur Paul Anderson et le professeur Pavel Ivanov de la Harvard Medical School, Naama Knafo de l’université de Tel Aviv, le docteur Thomas G. Moens et le professeur Ludo Van Den Bosch de la KU Leuven, ainsi que le docteur Adrian Higginbottom et le docteur John Copper-Knock de l’université de Sheffield.
Le professeur Eran Hornstein dirige le centre Nella et Leon Benoziyo pour les maladies neurologiques. Ses recherches sont également financées par Edward et Janie Moravitz. Le professeur Hornstein est détenteur de chaire professorale de la famille Mondry.


