06 Mai Les chaperons s’occupent de tout
Comprendre comment certaines protéines travaillent en équipe pourrait apporter un éclairage nouveau sur la manière dont les cellules se défendent contre les maladies neurodégénératives.
Les protéines sont les chevaux de bataille de la cellule, accomplissant la plupart des tâches nécessaires pour nous maintenir en vie et en bonne santé. Mais quand elles sont endommagées, les protéines peuvent former des agrégats toxiques appelés fibres amyloïdes. Dans le cerveau, ces agrégats sont reliés à des maladies comme Alzheimer, Parkinson et de nombreuses autres maladies neurodégénératives. Jusqu’ici, les scientifiques pensaient qu’une fois les amyloïdes formées, il n’y avait pas de retour arrière possible. Il s’avère cependant que la coopération de deux familles de protéines permet de dissoudre les amyloïdes, ramenant ainsi les cellules à un état sain.

(de gauche à droite) Les docteurs Ofrah Faust, Meital Avraham, Rina Rosenzweig et Nir London
Dans deux papiers récents qui se font écho, le docteur Rina Rosenzweig du Département de Biologie Structurale de l’Institut Weizmann des Sciences, en collaboration avec des chercheurs de l’université d’Heidelberg (ZMBH) et du centre allemand pour la recherche sur le cancer (DKFZ), a découvert les mécanismes par lesquels ces deux familles de protéines – appelées Hsp70 et Hsp40 – brisaient les amyloïdes. Cette action fait partie des missions générales des protéines chaperons de la cellule dont le but est de maintenir les autres protéines à la bonne concentration.
Dans le premier article, le docteur Anne Wentink, de l’équipe du professeur Bernd Bukau du ZMBH, a découvert que la clef pour dissoudre les fibres amyloïdes était d’atteindre une accumulation dense de chaperons Hsp70 en un point. Une fois cet objectif atteint, les molécules Hsp70 s’attachent aux protéines individuelles des fibres amyloïdes et les tirent jusqu’à ce qu’elles s’en libèrent. Dans l’autre article, les docteurs Ofrah Faust et Meital Abayev-Avraham de l’équipe du docteur Rosenzweig ont découvert un mécanisme de régulation unique qui permet à la seconde famille de chaperons, les Hsp40, de créer l’agrégat d’Hsp70 nécessaire pour briser les fibres amyloïdes.
En utilisant des méthodologies de pointe de spectroscopie à résonnance magnétique nucléaire et les instruments de dernière génération de l’Institut Clore pour la spectroscopie et l’imagerie à résonnance magnétique à haute résolution de l’Institut Weizmann, les chercheurs de l’Institut ont réussi à obtenir la structure d’un des membres de la famille Hsp40 appelé DnaJB1. Ce chaperon se lie aux fibres amyloïdes et aide Hsp70 à les dissoudre. Une analyse de la structure de DnaJB1 révèle que c’est sa seule tâche. En effet, il se comporte comme un interrupteur à deux niveaux d’un type qui était jusqu’ici inconnu.
Les scientifiques ont découvert que DnaJB1 contient une structure hélicoïdale unique qui bloque temporairement le site de liaison des chaperons Hsp70. Quand les molécules Hsp70 approchent, elles s’attachent d’abord à DnaJB1 via sa portion désordonnée appelée « queue » par les chercheurs. Cette action d’attache libère le bloc hélicoïdal, permettant ainsi à Hsp70 de se connecter à son site de liaison dédié sur DnaJB1 où il devient actif et commence à séparer les fibres amyloïdes. DnaJB1 relâche ensuite Hsp70 et réactive le verrou pour le chaperon suivant, il peut ainsi attraper d’autres Hsp70 et les activer au même endroit de la fibre amyloïde. Cette action répétée génère un agrégat de chaperons assez grand pour disloquer les amyloïdes.
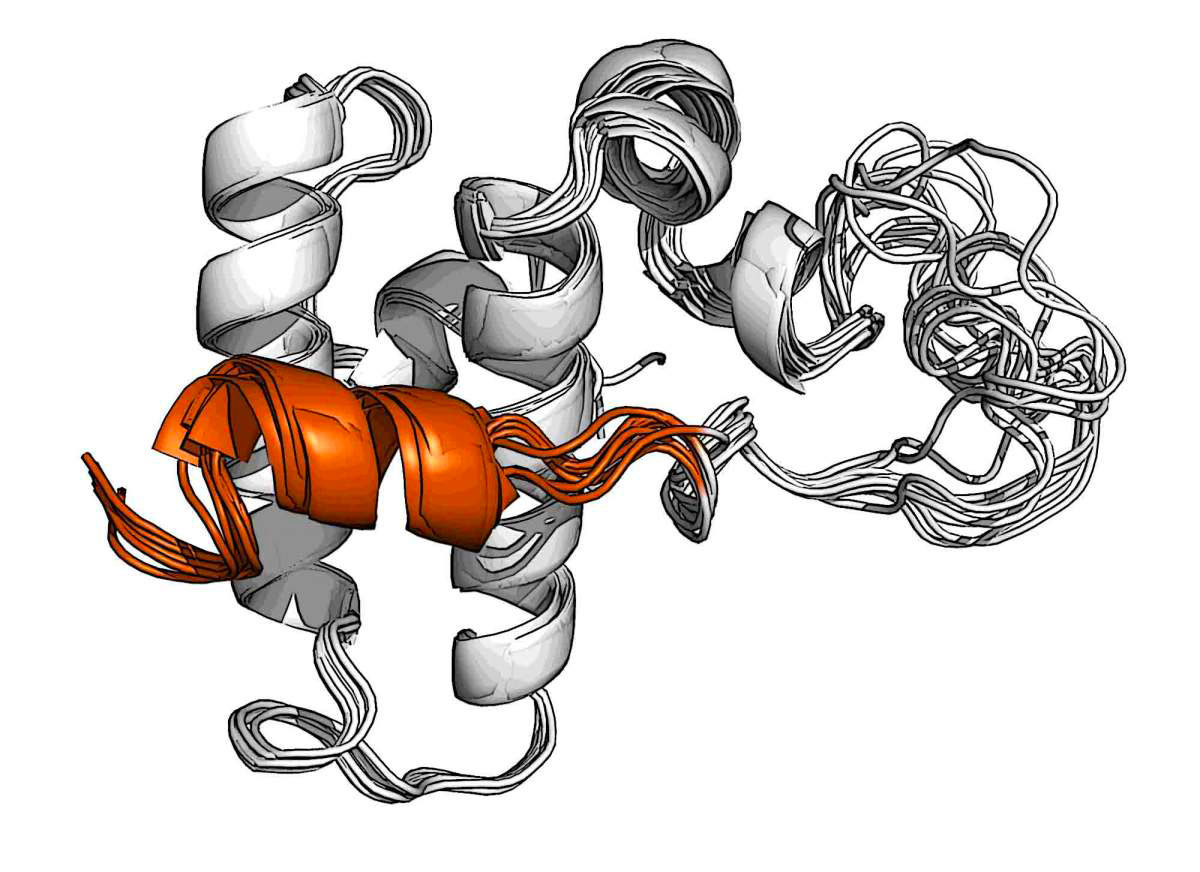
Un verrou hélicoïdal (orange) sur le chaperon DnaJB1 bloque le site où se lie habituellement un autre chaperon, Hsp70
La découverte de ces détails moléculaires pose l’hypothèse que la progression des maladies neurodégénératives pourrait être, entre autres, liée à l’interruption de ce mécanisme de régulation en deux étapes, ouvrant ainsi une voie de recherche jusqu’ici inexplorée dans la bataille contre la neurodégénérescence. De plus, les découvertes de ces études pourraient permettre de mieux comprendre d’autres processus cellulaires vitaux : les scientifiques pensent en effet que des structures hélicoïdales actives similaires pourraient exister dans d’autres chaperons Hsp40.
D’autres chercheurs ont participé à cette étude : les membres de l’équipe du docteur Rosenzweig du Département Biologie Structurale de l’Institut Weizmann, les membres de l’équipe du professeur Bernd Bukau de l’université d’Heidelberg et le docteur Nir London du Département Chimie Organique de l’Institut Weizmann des Sciences.
Les recherches du docteur Rina Rosenzweig sont financées par la fondation pour la promotion des sciences de la vie Abisch Frenkel, le fonds Blythe Brenden-Mann pour les nouveaux scientifiques et le conseil européen pour la recherche.


