22 Avr Cancer, ouvrir une brèche
Une cause possible de la résistance du cancer à l’immunothérapie pourrait être inversée
L’immunothérapie – provoquer l’attaque du cancer par le propre système immunitaire du patient – est un traitement prometteur pour de nombreux types de cancers, mais en pratique, cette nouvelle thérapie n’est administrée qu’à un petit nombre de patients sur lesquels on pense que le traitement va agir et il n’agit en réalité que sur la moitié d’entre eux. Une nouvelle étude menée à l’Institut Weizmann des Sciences en collaboration avec le NCI et l’Université Ben-Gurion émet une hypothèse laquelle ce traitement peut échouer dans de nombreux cas. L’équipe de recherche a identifié une information génétique induite par une substitution dans l’ADN de certaines cellules cancéreuses qui distingue les tumeurs vulnérables aux attaques des cellules immunitaires de celles qui sont plus résistantes. Cette découverte pourrait mener à de meilleurs outils diagnostiques permettant de prédire quels cancers répondront à l’immunothérapie.
Le docteur Ayelet Erez du département de régulation biologique de l’Institut, en collaboration avec le professeur Eytan Ruppin de l’Institut national pour le cancer aux États-Unis, ont déjà montré que de nombreuses tumeurs provoquent des ravages par le biais d’un cycle métabolique simple – le cycle de l’urée. Ils ont notamment découvert que de nombreux cancers sont caractérisés par la mise sous silence d’un gène appelé ASS1 qui transporte l’excès d’azote dans le sang vers l’urine. Les enfants nés avec des mutations de ce gène souffrent de maladies graves, mais le docteur Erez a découvert que les cancers dans lesquels l’expression de ce gène est complètement supprimée se développent plus rapidement en utilisant l’azote qui serait évacué en temps normal pour synthétiser des acides nucléiques pyrimidines. Cependant, ces cancers possèdent une caractéristique génétique qui peut se retourner contre eux ; la concentration trop élevée de pyrimidine entraine une substitution dans l’ADN tumoral : la pyrimidine y remplace la purine. Le docteur Erez et le professeur Rupin ont de plus montré que cette substitution rend le cancer plus vulnérable à certains types d’immunothérapie.
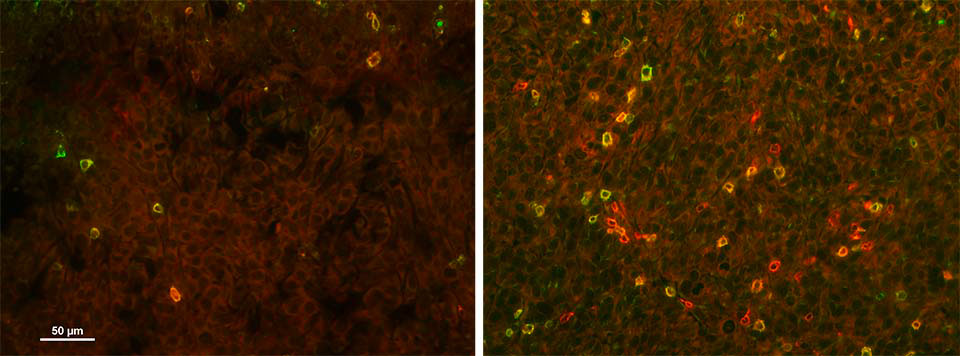
Des cellules de cancer du sein traitées avec un inhibiteur de purine (à droite) ou non traitées (à gauche) ont été injectées à deux souris femelles qui ont ensuite reçu une immunothérapie classique. Les images montrent une plus grande infiltration de lymphocytes T après le pré-traitement.
Images produites par le docteur Raya Eilam
« La simple analyse séquentielle d’une biopsie peut révéler s’il y a trop de mutations où la purine est remplacée par la pyrimidine dans un cancer et ainsi prédire comment les cellules cancéreuses pourraient répondre à l’immunothérapie, » dit le docteur Erez, qui ajoute : « Cela pourrait être un outil pour prédire, sur la base du nombre de mutations de purine en pyrimidine, le succès d’un traitement immunitaire plus précis que ceux dont on dispose aujourd’hui. »
Dans cette étude, le docteur Erez et son équipe, en collaboration avec celle du professeur Rupin du NCI, se sont concentrés sur des cancers possédant la caractéristique opposée : leur gène ASS1 est surexprimé. Ces cancers, dont certains cancers communs des poumons, du sein et du colon, produisent plus de l’autre type de nucléotides – la purine – et moins de pyrimidine. L’équipe a émis l’hypothèse que de telles tumeurs seraient moins sensibles à l’immunothérapie. Mais pour commencer : pourquoi ces cancers surexpriment-ils le gène ASS1 ?
L’équipe a tout d’abord étudié les données existantes sur les génomes de cellules cancéreuses et a caractérisé les voies métaboliques impliquant le gène ASS1 – c’est-à-dire les chaines de réactions biochimiques auxquelles il participe – en cas de cancer. Ils ont découvert que ce gène joue un rôle dans la gluconéogenèse – la fabrication de sucre – et donc que les cellules dans lesquelles ASS1 est surexprimé ont développé une méthode de croissance alternative en conditions de stress avec un accès limité au glucose. L’activation de la voie de gluconéogenèse provoque une augmentation de la voie métabolique ramifiée, ce qui entraîne une surproduction de purine plutôt que de pyrimidine. L’équipe avait précédemment montré que la pyrimidine était impliquée dans la production d’antigènes qui attirent les lymphocytes T qui sont au cœur de l’immunothérapie. Elle a donc émis l’hypothèse que déséquilibrer le système dans le sens opposé pourrait avoir un effet important sur la résistance à l’immunothérapie. De plus amples expériences dans des tumeurs chez des souris et des humains ont confirmé cette idée.
La question qui s’est ensuite posée a été la suivante : pouvons-nous réguler l’équilibre purine-pyrimidine afin d’améliorer la réponse à l’immunothérapie de ces tumeurs ? Pouvons-nous finalement, en réduisant la purine et en augmentant la pyrimidine, rendre les cellules cancéreuses réceptives à l’immunothérapie ?
En travaillant sur des tissus de cancers humains fournis par le Centre médical Soroka et l’Université Ben-Gurion du Néguev, les chercheurs ont administré une molécule qui inhibe la synthèse de purine avant de démarrer l’immunothérapie. Ils ont découvert que ce prétraitement, comme ils l’espéraient, rendaient le cancer bien plus vulnérable à l’immunothérapie qui suivait – qui utilise un médicament connu pour être un inhibiteur des points de contrôle, qui « arme » les lymphocytes T et leur permet d’attaquer les cellules cancéreuses.

Le docteur Ayalet Erez
Le docteur Erez et son équipe, en collaboration avec l’équipe du professeur Ruppin du NCI, travaillent actuellement sur différentes études qui pourraient rendre ces découvertes applicables sur le plan clinique, menant des expériences sur de petites molécules déjà approuvées pour l’utilisation sur des humains afin de voir si elles peuvent inverser métaboliquement l’équilibre et rendre vulnérable des tumeurs jusqu’ici résistantes à l’immunothérapie.
D’autres personnes ont également participé à cette étude : Rom Keshet, MD, PhD, et le docteur Lital Adler du laboratoire du professeur Ruppin, le docteur Joo Sang Lee de l’Institut national pour le cancer et Muhammed Iraqi de l’Université Ben-Gurion.
Les recherches du docteur Ayelet Erez sont financées par le Centre intégré Moross pour le cancer, l’Institut Sagol pour la recherche sur la longévité, la fondation Adelis, la fondation Rising Tide, Robin Lynn et Lawrence S. Blumberg, Manya et Adolph Zarovinsky et le conseil européen pour la recherche. Le docteur Erez est détentrice de la chaire pour le développement de carrière Leah Omenn.


