07 Oct Quand la température monte, il faut augmenter l’ac4C
Les marqueurs de résistance à la chaleur de l’ARN bactérien nous en disent plus sur les maladies humaines.

Certaines bactéries adorent l’odeur de souffre des gaz chauds
Parlons de s’adapter à la difficulté : des archées unicellulaires s’épanouissent au milieu de gaz surchauffés éjectés par des ouvertures de la croûte terrestre.
(archées : microorganismes unicellulaires procaryotes c.a.d. sans noyau ni organite)
Mais comment résistent-elle à de telles températures ? Des chercheurs de l’Institut Weizmann des Sciences, en collaboration avec des scientifiques américains, ont découvert un mécanisme utilisé par ces organismes leur permettant de survivre dans les fissures du sol d’une île japonaise d’où s’échappe de la vapeur . Ce mécanisme jusqu’ici inconnu repose sur une sorte de système de résistance de l’ARN à la chaleur que les cellules peuvent ajuster en fonction de leur environnement. Cette découverte de nouvelles voies pour l’étude de la santé et des maladies de l’homme.
Pour Thermococcus kodakarensis (une espèce d’archée), un 50°C brûlant est désagréablement froid. Cet organisme microscopique vit dans des solfatares – des ouvertures dans le sol qui émettent des gaz sulfurés près des côtes de l’île de Kotakara au Japon, et prospère à des températures proches du point d’ébullition de l’eau (100°C).
Cet organisme a attiré l’attention de chercheurs de l’Institut Weizmann qui étudiaient une ancienne modification de la composition de l’ARN – préservée au fil de l’évolution. Cette modification est un marqueur chimique pouvant affecter la stabilité et la structure de l’ARN. Il est appelé ac4C – ce qui indique la fixation d’un marqueur acétyle en position 4 d’un composant de l’ARN appelé Cytidine. Les marqueurs chimiques sur les molécules d’ARN possèdent différentes fonctions, modifiant le code génétique de la cellule ainsi que les outils cellulaires basés sur l’ARN.

(de gauche à droite) Docteur Donna Matzov, docteur Aldema Sas-Chen, docteur Moran Shalev-Benami et docteur Schraga Schwartz
Le docteur Aldema Sas-Chen et ses collègues du laboratoire du docteur Schraga Schwartz du département de génétique moléculaire, en collaboration avec le docteur Jordan L. Meier du National Cancer Institute américain, ont développé une méthode pour manipuler chimiquement l’ARN afin de rendre l’ac4C « visible » au cours du séquençage. Les scientifiques ont émis l’hypothèse que l’ac4C renforce les molécules d’ARN et ont commencé à chercher des cas dans lesquels une consolidation supplémentaire pourrait être bénéfique. Cela les a menés au Thermococcus kodakarensis, un organisme dont l’ARN nécessite une consolidation forte car c’est une molécule qui se désintègre habituellement à haute température.
Quand les chercheurs ont appliqué leur méthode à l’ARN de cet organisme, ils ont découvert des quantités étonnantes d’ac4C : alors que les cellules humaines et les levures ne contiennent que quelques unes de ces modifications, chacune de ces créatures unicellulaires résistantes à la chaleur en contient près de 400. La plupart des modifications ac4C étaient notamment trouvées dans l’ARN des ribosomes, la machine à fabriquer les protéines construite autour des molécules d’ARN repliées ; ces molécules contenaient jusqu’à 170 modifications ac4C. Les scientifiques ont modifié génétiquement Thermococcus kodakarensis afin de supprimer l’enzyme produisant ac4C et ont découvert que les organismes mutants devenaient vulnérables à la chaleur ce qui suggère qu’ac4C est effectivement essentiel pour leur survie à haute température.
Les scientifiques se sont ensuite associés à l’équipe du docteur Moran Shalev-Benami du département de biologie structurale pour cartographier plus précisément l’ac4C en trois dimensions. Le docteur Donna Matzov, du laboratoire du docteur Shalev-Benami, a utilisé la cryomicroscopie électronique pour visualiser la structure atomique des ribosomes et déterminer exactement où se situe l’ac4C et ce qui arrive à la structure du ribosome en son absence. Elle a remarqué que, contrairement au ribosome humain sur lequel le marqueur n’est attaché qu’à deux endroits du site actif, chez Thermococcus kodakarensis, il peut être attaché sur tout le ribosome. Elle a de plus découvert que le nombre de marqueurs ac4C chez les créatures unicellulaires augmentait avec la température : il n’y en a quasiment pas à 50°C mais leur nombre grimpe en flèche dès 80°C et continue d’augmenter avec la température. Cette liaison progressive a mené les chercheurs à la conclusion que cet ajout de plus en plus d’ac4C est un mécanisme d’adaptation dynamique – comme superposer des couches d’isolant thermique– pour protéger le ribosome de l’augmentation de température.
Les découvertes réalisées au cours de cette étude suggèrent que les modifications d’ac4C constituent une technique cellulaire d’adaptation à un environnement changeant, inconnue jusqu’ici. La méthode développée pour mesurer et cartographier l’ac4C pourrait être utilisée dans d’autres études pour explorer le rôle potentiel de ces modifications dans un grand nombre de changements de contexte. Cette méthode pourrait par exemple permettre de vérifier si l’ac4C aide à protéger l’ARN des cellules humaines quand nous avons de la fièvre ou sous d’autres conditions stressantes comme un cancer ou une maladie neurodégénérative. En outre, cette méthode pourrait aider à révéler si une mutation dans l’enzyme responsable de la création d’ac4C, qu’on retrouve dans au moins deux types de cancers et dans certaines formes de vieillissement prématuré, contribue à ces maladies.
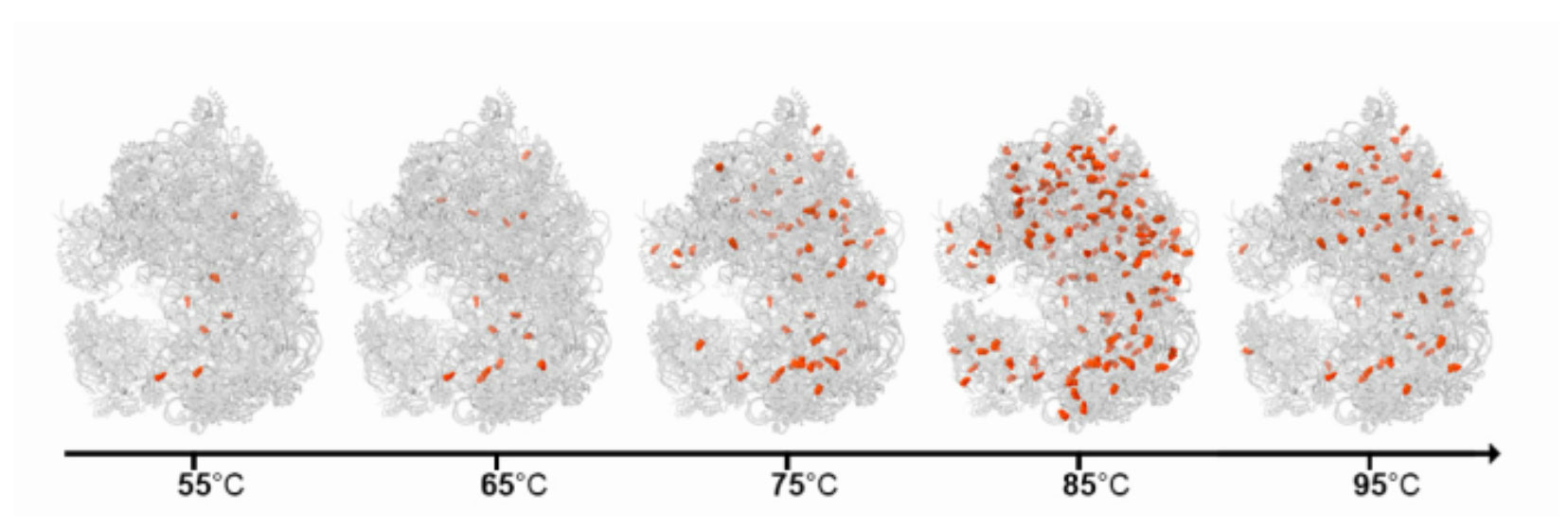
Le nombre de marqueurs ac4C (orange) sur le ribosome (gris) de Thermococcus kodakarensis augmente progressivement avec la température
Différents chercheurs ont participé à cette étude : Ronit Nir, Ran Shachar et Jesse Hartmann du département de génétique moléculaire de l’Institut Weizmann des Sciences ; Justin M. Thomas, Kellie D. Nance, Keri M. Bryson, Chloe A. Briney et Supuni Thalalla Gamage du National Cancer Institute américain ; Masato Taoka, Yuko Nobe et le professeur Toshiaki Isobe de la Tokyo Metropolitan University ; Geraldy L.S. Liman, Brett W. Burkhart et le professeur Thomas J. Santangelo de la Colorado State University ; Michaella J. Levy, Michael P. Washburn et Laurence Florens de l’Institut Stowers pour la recherche médicale à Kansas City, USA ; Ryan T. Fuchs et G. Brett Robb de New England Biolabs, Inc., Ipswich, Massachusetts, USA ; Sunny Sharma de la Rutger University et Qishan Lin de l’Université d’Albany, USA.
Les recherches du docteur Schragga Schwartz sont financées par l’Institut Ilse Katz pour la recherche sur la résonnance magnétique et la science des matériaux et la succession Emile Mimran. Le docteur Schwartz est détenteur de la chaire permanente pour le développement de carrière Robert Edward et Roselyn Rich Manson.
Les recherches du docteur Moran Shaley-Benami sont financées par l’Institut Ilse Katz pour la recherche sur la résonnance magnétique et la science des matériaux, le Centre pour l’assemblage et les structures biomoléculaires Helen et Milton A. Kimmelman, le Zuckerman STEM Leadership Program, le laboratoire Joseph et Wolf Lebovic, le fonds de dotation Dov et Ziva Rabinovich pour la biologie structurale, le fonds Harmstieg pour les nouveaux scientifiques, la fondation Pearl Welinsky Merlo, Paul et Tina Gardner et le Docteur et Madame Donald Rivin.


