
14 Sep Protocoles contre le cancer : une nouvelle approche pour prédire les résultats d’un traitement
Les recherches de l’Institut Weizmann des Sciences montrent que l’hétérogénéité des tumeurs de mélanomes empêche une réponse immunitaire efficace.
La diversité – pour les cellules cancéreuses en tout cas – n’est pas une bonne chose. Les recherches de l’Institut Weizmann des Sciences montrent que dans le cas d’un mélanome, les tumeurs avec des cellules différenciées en différents sous-types sont moins sensibles au système immunitaire, ce qui réduit ainsi l’efficacité de l’immunothérapie. Les découvertes de cette étude, publiée aujourd’hui dans Cell, pourraient apporter de meilleurs outils pour concevoir des protocoles personnalisés pour les patients atteints d’un cancer, tout en ouvrant de nouvelles voies de recherche de vaccins anticancers.
Bien que les décès causés par les mélanomes aient baissé ces dernières années grâce aux nouveaux traitements d’immunothérapie, le professeur Yardena Samuels du Département de Biologie cellulaire et moléculaire de l’Institut voulait savoir pourquoi de nombreux patients ne répondaient pas à ces thérapies. Les causes n’en sont pas claires, même si l’hypothèse principale, appuyée par quelques études, est que les tumeurs avec plus de mutations – une « charge mutationnelle tumorale » importante – sont plus enclines à répondre à l’immunothérapie. Ainsi, certains patients dépensent des fortunes pour subir des radiations ou une chimiothérapie pour faire muter leurs tumeurs bien qu’aucune relation de cause à effet n’ait encore été prouvée. Le professeur Samuels et ses collègues étaient surpris par des études suggérant une autre corrélation possible – entre l’hétérogénéité (c’est-à-dire la diversité génétique des cellules tumorales) et la réponse à la thérapie. Afin d’explorer cette théorie, l’équipe a dû développer un nouveau système expérimental pour déterminer quels facteurs jouent véritablement un rôle.
Dans cette étude, dirigée par les docteurs Yochai Wolf et Osnat Bartok dans le laboratoire du professeur Samuels, les chercheurs ont pris des cellules de mélanome de souris et les ont exposées à une lumière UV connue pour favoriser ce cancer. Ceci augmente à la fois les mutations et les hétérogénéités cellulaires pendant la croissance. Lorsqu’ils ont injecté ces cellules et des cellules classiques de mélanome aux souris, celles qui avaient été irradiées se sont multipliées plus rapidement tout en se montrant plus agressives.
Bien que ces cellules présentent une plus grande charge mutationnelle – et ainsi auraient dû mieux répondre à l’immunothérapie – elles sont en réalité moins susceptibles d’être éradiquées que celles de la tumeur originale. Bien qu’elles comportent une charge mutationnelle importante, ces cellules présentaient aussi une forte hétérogénéité et les chercheurs ont émis l’hypothèse que c’est cette dernière qui dirige la résistance.
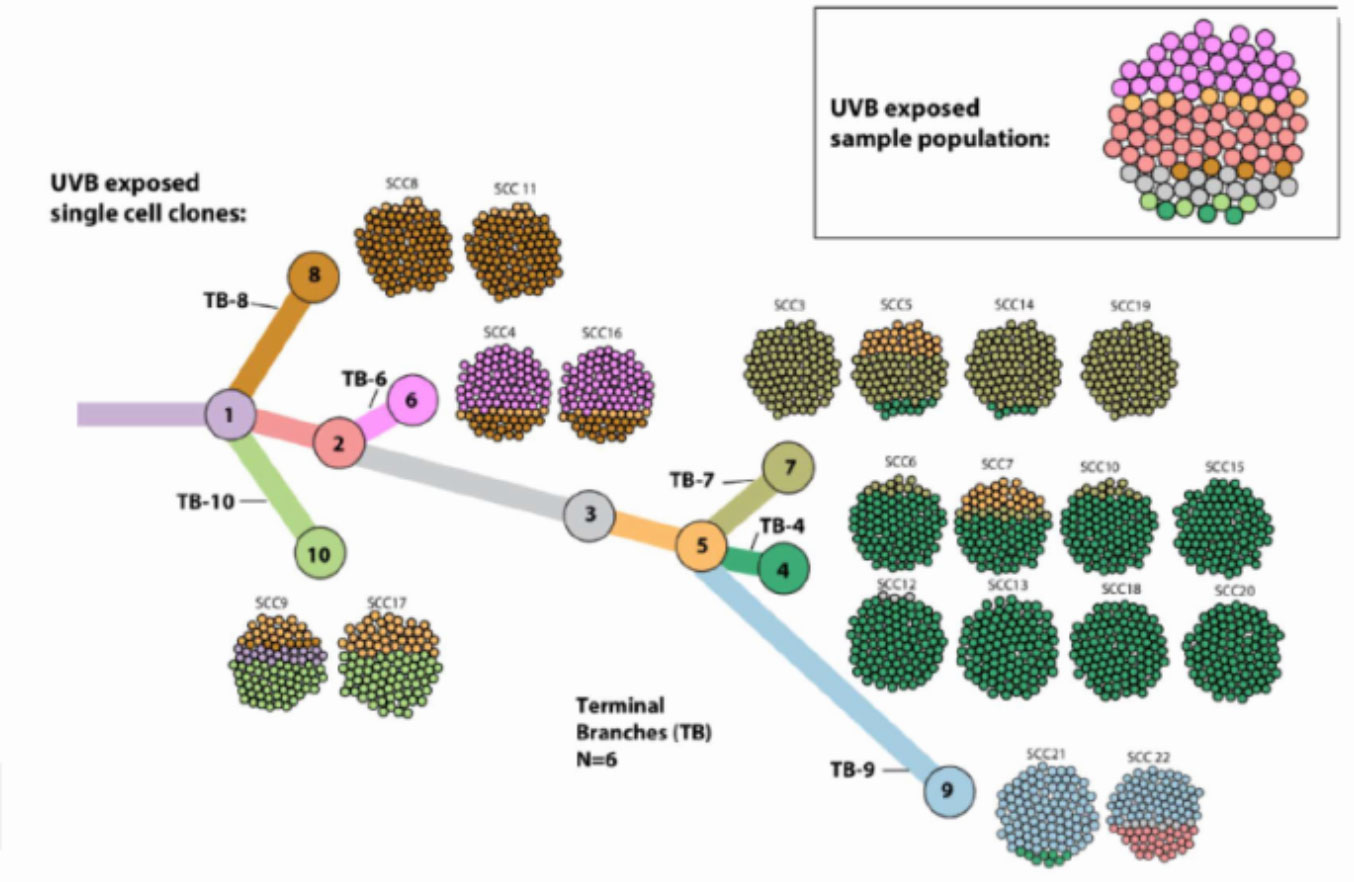
Les cellules tumorales ont été cartographiées sur un arbre phylogénétique en basé sur leur hétérogénéité permettant aux chercheurs de nouvelles expériences
Puisque la charge mutationnelle et l’hétérogénéité vont souvent de pair, les chercheurs avaient besoin de trouver une façon de les étudier individuellement. Ils ont isolé des cellules d’une culture cancéreuse à croissance agressive, et ont initié de nouvelles cultures à partir de chacune d’elles. Ils ont ainsi obtenu 22 nouvelles cultures, chacune avec un faible niveau d’hétérogénéité mais présentant un certain nombre aléatoire de mutations .
Quand ils ont injecté ces cellules à faible hétérogénéité à des souris, les chercheurs ont été surpris de découvrir que toutes les tumeurs, qu’elles portent une petite ou une forte charge mutationnelle, grossissaient lentement ou même disparaissaient sans immunothérapie. Afin de voir si les systèmes immunitaires des souris étaient effectivement responsables de la mort des cellules cancéreuses, ils ont renouvelé l’expérience chez des souris avec un système immunitaire affaibli : le cancer s’est alors développé rapidement.
Pour mieux comprendre la réponse immunitaire, les chercheurs ont réitéré l’expérience sur des souris conçues génétiquement sans cellules T –cellules immunitaires connues pour combattre le cancer. « Les résultats étaient similaires à ceux obtenus chez les souris avec un faible système immunitaire, » dit le docteur Wolf. « Quand nous avons observé les cellules T de différentes tumeurs, nous avons découvert qu’elles étaient beaucoup plus actives dans le cas d’une croissance homogène et moins dans le cas d’une croissance hétérogène. » En fait, les chercheurs ont découvert que dans le cas de tumeurs grandissant de façon homogène, les cellules T pénètrent jusqu’au centre de la tumeur tandis que dans le cas de croissance hétérogène de la tumeur, les cellules T restent à l’extérieur de celle-ci et présentent différents types – supprimant notamment l’activité immunitaire.
« Nous avons montré la différence entre deux extrêmes – très homogènes et très hétérogènes, » dit le docteur Bartok, « mais la plupart des cancers se situent quelque part entre les deux. Pour générer systématiquement des tumeurs avec des niveaux d’hétérogénéité intermédiaire, nous avons créé un arbre phylogénétique de la lignée parentale hétérogène, et avons cartographié la façon dont les sous-types apparaissaient au fil du temps. Nous avons ensuite créé des « cocktails » de lignées de cellules homogènes basés sur cet arbre, avec plus ou moins de combinaisons hétérogènes, et les avons injectés à des souris. » Comme prévu, plus les cocktails de cellules étaient homogènes, plus le système immunitaire des souris éradiquait le cancer facilement ; à l’opposé, plus les tumeurs étaient hétérogènes, plus leur croissance devenait agressive.
« Nous avons découvert que tester le nombre de sous-types de cellules et leur place sur l’arbre phylogénétique donne un meilleur indicateur que la charge mutationnelle pour prédire le succès de l’immunothérapie, » dit le professeur Samuels. « Nous avons également étudié les données venant de patients atteints de mélanome et ayant subi une immunothérapie et avons découvert une forte corrélation entre ces facteurs et le succès du traitement. Finalement, nous projetons d’utiliser le système expérimental que nous avions créé pour travailler sur le développement de protocoles applicables aux patients atteints de cancer. »
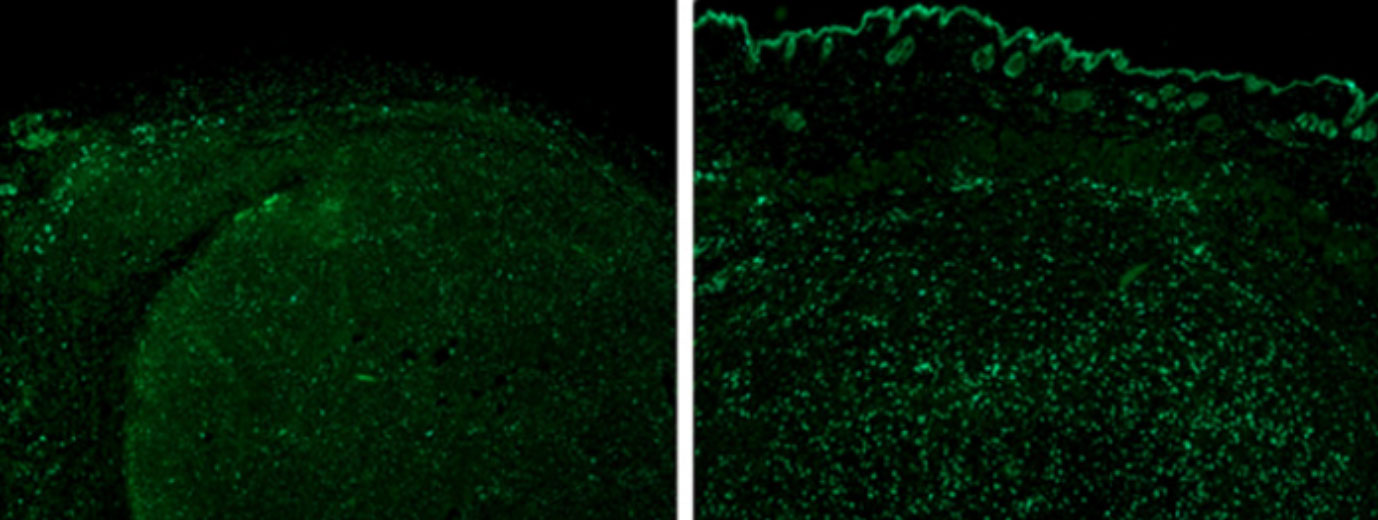 Les cellules T tueuses de cancer (en vert) dans des tumeurs de mélanomes hétérogènes (à gauche) ou homogènes (à droite). Dans les tissus hétérogènes, les cellules T restent à l’extérieur de la tumeur tandis que dans les tissus homogènes, elles pénètrent jusqu’au cœur
Les cellules T tueuses de cancer (en vert) dans des tumeurs de mélanomes hétérogènes (à gauche) ou homogènes (à droite). Dans les tissus hétérogènes, les cellules T restent à l’extérieur de la tumeur tandis que dans les tissus homogènes, elles pénètrent jusqu’au cœur
D’autres personnes ont également participé à cette étude : le professeur Eytan Ruppin de l’Institut National du Cancer, département de l’Institut américain de la Santé, le professeur Lea Eisenbach du Département d’Immunologie de l’Institut Weizmann, le docteur Yishai Levin du Centre national israélien Nancy et Stephen Grand pour la médecine personnalisée de l’Institut Weizmann, le professeur Martin Miller de l’Université de Cambridge, le professeur Eli Pikarsky de l’Université hébraïque – école de médecine Hadassah, le professeur Arie Admon du Technion – Institut israélien de technologie et le professeur Charles Swanton de l’Université de Londres.
Les recherches du professeur Yardena Samuels sont financées par l’EKARD, Institut pour la recherche sur le diagnostic du cancer, la banque tumorale Weizmann-Brésil, le laboratoire créé au nom du fonds Margot et Ernst Hamburger, le fonds de la famille Wagner-Braunsberg pour la recherche sur le mélanome, le fonds Jean-Jacques Brunschwig pour la génétique moléculaire du cancer, le fonds de la famille Comisaroff, la fondation Rising Tide, la Fondation Ramón Areces, la dotation Meyer Henri pour le cancer, Ted et Sylvia Quint, Jean Jacques Roboh et le Conseil européen de la recherche. Le professeur Samuels est le détenteur de la Chaire professorale de la famille Knell.


