05 Nov Profiler un tueur dans le sang chaud
Les scientifiques et médecins Israéliens développent une nouvelle technologie pour profiler la composition génétique unique des cellules tumorales de myélome multiple pour un meilleur diagnostic et un meilleur traitement.
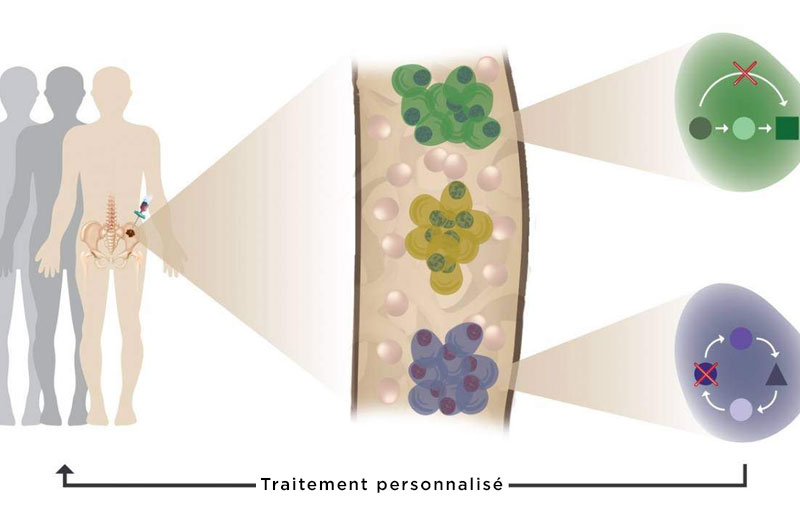 Hétérogénéité tumorale, évolution clonale et résistance aux médicaments révélées par l’utilisation du profiling de cellule unique chez des patients atteints de myélome multiple, Illustration : Noa Godin
Hétérogénéité tumorale, évolution clonale et résistance aux médicaments révélées par l’utilisation du profiling de cellule unique chez des patients atteints de myélome multiple, Illustration : Noa Godin
Le cancer survient lorsque les cellules perdent le contrôle. Décrypter le « programme» des cellules cancéreuses – qui décrit comment les cellules cancéreuses détournent des mécanismes biologiques spécifiques au profit d’une prolifération incontrôlée – mènera à des moyens plus efficaces de les combattre. L’effort commun des scientifiques de l’Institut Weizmann des Sciences et des médecins des plus importants départements d’hémato-oncologie d’Israël ont réussi à créer des profils détaillés du cancer myélomateux aussi bien au stades précancéreux chez des patients atteints de myélome multiple nouvellement diagnostiqué, qu’après traitement et lors de rechutes .
Ces programmes détaillés nous aideront dans l’avenir à obtenir un diagnostic précis et un traitement de cette maladie
Le myélome multiple est le deuxième cancer du sang le plus fréquent. Le myélome multiple se produits lorsque les cellules plasmatiques de la moelle osseuses – les cellules qui produisent des anticorps – prolifèrent hors de contrôle et entrainent différentes défaillances d’organes ou même leur mort. Malgré plusieurs années de recherche et une amélioration significative récente de la survie des patients atteints de myélome avec des nouvelles modalités d’immunothérapie, beaucoup de patients succombent à cause d’une réponse limitée aux traitements et tous rechutent. Un point d’achoppement majeur dans le diagnostic du myélome tient du fait que chaque patient est unique et les tests sanguins courants sont incapables d’identifier précocement la maladie et de déterminer quel traitement chaque patient devrait recevoir . Ainsi, les patients dont les tests sanguins routiniers révélent quelques indices caractéristiques de la maladie au stade précoce et précancéreux sont suivis de près avec une stratégie de « veille et d’attente ». Mais chaque année 1% de ces patients perdent à cette « Roulette Russe » et développent pleinement la maladie. Jusqu’à récemment, il n’y avait aucun moyen de distinguer ceux qui vont développer la maladie de ceux qui ne le feront pas.
Le docteur Guy Ledergor, MD/PhD, et le docteur Assaf Weiner dans le groupe du professeur Ido Amit au sein du Département d’Immunologie de l’Institut Weizmann des Sciences, ainsi que le professeur Amos Tanay du Département des Régulations Biologiques et du Département d’Informatique et Mathématiques Appliquées ont pensé qu’une méthode très sensible développée par le groupe, et nommée séquençage d’ARN de cellules uniques pourrait constituer une nouvelle approche pour comprendre comment se fait un myélome multiple et imaginer de nouvelles approches plus efficaces pour diagnostiquer et traiter cette maladie dévastatrice. Avec cette vision à l’esprit, le programme du « Laboratoire au Chevet du Malade » de l’Institut Weizmann des Sciences dirigé par le professeur Gabi Barbash a engagé une tentative à l’échelle nationale pour rassembler tous les départements d’Hémato-oncologie d’Israël.
Cette nouvelle méthode séquence l’ARN de milliers de cellules individuelles du sang ou de la moelle, afin d’identifier le programme génétique spécifique qui est actif dans chacune des cellules individuelles. Pour comprendre le programme du cancer de myélome, les scientifiques ont tout d’abord créé un modèle à haute résolution de cellule plasmatique normale en séquençant des dizaines de milliers de cellules d’individus sains ayant subi une opération de la hanche qui ont servi d’échantillon témoin. Toutes les cellules plasmatiques de ces patients « témoins » étaient hautement similaires aussi bien chez un même patient qu’entre individus, mettant en évidence un programme unique commun aux cellules plasmatiques normales. La comparaison du programme normal à celui des malades a montré que les programmes des cellules cancéreuses de myélome sont extrêmement hétérogènes, chaque patient exprimant un programme propre et certains patients présentant même plusieurs programmes différents .
Ces efforts communs des médecins et des scientifiques de l’Institut Weizmann des Sciences ont permis de démontrer qu’il est possible d’identifier même un très petit nombre de cellules malignes dans le sang au stade très précoce (pré-cancer), établir un diagnostic plus précis et un choix de traitement adapté à la « personnalité » de la maladie de chaque patient. Par la suite, il serait possible de remplacer pour le suivi de ces patients, les biopsies de la moelle osseuse, douloureuses et invasives, par des tests sanguins significatifs. Cette méthode pourrait aider les malades du myélome multiple à recevoir plus tôt des traitements mieux adaptés, et prévenir la rechute qui suit souvent la chimiothérapie.
Cette étude et la méthode précise, employée pour la première fois au monde, et aujourd’hui publiée dans Nature Médecine peut contribuer à faire d’Israël le leader du diagnostic et du traitement des malades du myélome multiple.
Le Professeur Barbash annonce que ces découvertes constituent un début d’application à la recherche génomique clinique de la technologie de séquençage d’ARN de cellules uniques . « Nous établissons actuellement des collaborations similaires entre chercheurs hospitaliers et chercheurs scientifiques en recherche fondamentale afin de faire progresser le diagnostic et le traitement d’autres maladies »
« Si l’analyse génomique de cellules uniques a seulement été utilisée aujourd’hui dans quelques laboratoires de recherche, nous repoussons constamment les limites de la technologie afin d’en faire un outil de découverte et de diagnostic clinique majeur » dit le Professeur Amit. Un tel suivi peut être utile dans le diagnostic de signes précoces de nombreuses tumeurs malignes soit au stade précancéreux soit à la suite d’une rechute post-chimiothérapie,l’intégrant ainsi dans une approche personnalisée. Cela permettra de prendre des décisions basées sur les profils individuels de chaque cellule du patient à chaque stade de la maladie. Ces profils sont déjà utilisés pour créer des thérapies ciblées contre les cellules cancéreuses.
Les chercheurs ont utilisé une approche d’apprentissage automatique (machine learning) pour identifier automatiquement les cellules malignes parmi des dizaines de milliers de cellules. « Nous entrons dans une ère où big-data et machine learning vont apporter au médecin de nouvelles connaissances et une véritable compréhension des maladies dévastatrices comme le myélome multiple. » dit le docteur Weiner. « À l’avenir, les médecins pourront suivre la maladie en temps réel et traiter chaque patient selon le profil personnalisé de sa maladie, peut-être même avant l’apparition des symptômes » dit Ledergor
Les recherches du Professeur Amit sont financées par la fondation David et Fela Shapell Family INCPM pour les études précliniques, l’institut Kekst Family contre les maladies génétiques, la fondation Thompson Family, fond de recherche sur l’Alzeimer, la fondation Adelis, le programme de bourses de recherche postdoctorale Eden et Steven Romick, le fond de recherche Steven B. Rubenstein pour la leucémie et autres troubles sanguins, la fondation Alan et Laraine Fischer ; les docteurs Herbert et Esther Hecht, la fondation Rising Tide, le BLG Trust, la fondation Anita James Rosen, la dotation pour la recherche sur les cellules souche Felix et Silvia Schnur, Isa Lior, la fiducie de bienfaisance de la famille Wolsen, Carla Hunter et Andre M. Schub, la succession Ruth Drobnes, la succession Lydia Hershkovich, la succession Alice Schwarz-Gardos et le conseil de recherche européen. Le Professeur Amit est le récipiendaire du prix de recherche innovante Helen et Martin Kimmel.
Les recherches du Professeur Amos Tanya sont financées par l’Institut de Bio-informatique Ilana et Pascal Mantoux qu’il dirige, le prix de recherche innovante Helen et Martin Kimmel, la fondation Edmond de Rothschild, le Professeur Ammon Shashua, le fond de recherche Steven B. Rubenstein pour la leucémie et autres troubles sanguins, David et Molly Bloom, la fondation William P and Gertrude Schweitzer, le fond de bienfaisance Ruth et Samuel Rosenwasser, la fiducie de bienfaisance de la famille Wolsen, Barry et Janet Lang, la succession Alice Schwarz-Gardos et le conseil de recherche européen.


